摘要:由NH3和 Zn(OH)42-的化学计量数.即1NO3-+4Zn+OH-+H2O→1NH3+4Zn(OH)42-,再根据电荷守恒可知OH-的化学计量数为7.之后用观察法得 H2O的化学计量数为6.答案:C[范例10]已知反应式①H2S+I2===S↓+2H++2I-,②H2SO3+2H2S===3S↓+3H2O,③2I-+Br2===I2+2Br-,④H2SO3+I2+H2O===SO42-+2I-+4H+下列各组中还原性由强到弱的是( )A.H2S.H2SO3.I-.Br- B.I-.Br-.H2SO3.H2SC.H2S.I-.Br-.H2SO3 D.I-.Br-.H2S.H2SO3解题思路:对于已发生的氧化还原反应.有:还原剂的还原性>氧化剂的还原剂,还原剂的还原性>还原产物的还原性.对于①H2S>H2SO3.对于③I->Br-.对于④H2SO3>I-.综合①②③④则还原性由强到弱的顺序:H2S.H2SO3.I-.Br-.答案:A失“足 警示:失“足 选B.对氧化性.还原性强弱的判断依据掌握得不好.容易忽视部分判断依据.因此.要想对该类题作出正确的解.必须加强对判断依据的识记和应用. [范例11]下列反应的离子方程式正确的是( )A.次氯酸钙溶液中通入过量二氧化碳Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClOB.硫酸亚铁溶液中加入过量过氧化氢溶液Fe2++2H2O2+4H+===Fe3++4H2OC.用氨水吸收少量二氧化硫NH3?H2O+SO2===NH4++HSO3-D.硫酸铁溶液加过量氨水Fe3++3NH3?H2O===Fe(OH)3↓+3NH4+解题思路:在选项A中.因为过量二氧化碳在水的存在下还要跟碳酸钙进一步反应:CaCO3+CO2+H2O===Ca2++2HCO3-.所以.正确的离子方程式应是ClO-+H2O+CO2===HCO3-+HClO.选项B中的离子方程式离子电荷不守恒.正确的写法应是2Fe2++H2O2+2H+===2Fe3++2H2O.选项C中.用氨水吸收少量二氧化硫时.由于氨水过量.HSO3-不可能作为最终产物.因为它可以与氨水发生反应:HSO3-+NH3?H2O===NH4++SO32-+H2O.因此.正确的离子方程式应该是2NH3?H2O+SO2===2NH4++SO32-+H2O.答案:D失“足 警示:离子方程式是中学化学教学的重点之一.它涉及到较多的化学基本概念和物质的性质.本题考查考生对离子反应的理解和书写离子方程式的技能.最大的干扰项是选项C. [范例12]Cu2S与一定浓度的HNO3反应.生成Cu(NO3)2.CuSO4.NO2.NO和 H2O.当NO2和NO的物质的量之比为1∶1时.实际参加反应的Cu2S与HNO3的物质的量之比为( )A.1∶7 B.1∶9 C.1∶5 D.2∶9解题思路:本题是守恒思想的综合应用.首先由NO2和NO的物质的量之比为1∶1.假设这两种物质的物质的量为1mol.1mol.得到的电子数为4mol.这样由得失电子守恒.可确定Cu2S的量为4/10=0.4mol.再由元素守恒可得:参加反应的总硝酸=表现酸性的硝酸+一氧化氮.二氧化氮的总物质的量=0.4×2+2=2.8mol.因此实际参加反应的Cu2S与 HNO3的物质的量之比为1∶7.答案:A失“足 警示:解决此类试题的关键是抓住电子与元素守恒关系.即得到电子的总数与失去电子的总数相等和质量守恒定律. [范例13]已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水.并放出热量bkJ.则乙炔燃烧的热化学方程式正确的是( )
网址:http://m.1010jiajiao.com/timu_id_320444[举报]
原子序数从小到大排列的四种短周期元素W、X、Y、Z,四种元素的原子最外层电子数之和等于13;W是原子半径最小的元素;由X、Y元素可组成非极性分子A,A在常温下为气体; 可以通过电解熔融Z的氯化物提取单质Z;B为浅黄色固体物质,且A与B反应可生成Y2气体.
(1)元素W是(填元素名称) ;写出B的电子式
(2)Z在A中燃烧生成黑色固体颗粒和大量白烟,写出发生的化学方程式: 该反应属于 (填写序号)
a 置换反应 b 化合反应 c 分解反应 d 复分解反应 e 氧化还原反应
(3)C是由X、Y、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是 ;试从结构的角度解释该物质比CaCO3更易分解的原因
(4)D是由W、X、Y 三种元素按原子个数比为1:1:2组成的一种弱酸,D在常温下为固体.D能使酸性高锰酸钾酸性溶液褪色,说明D具有 性,写出化学反应方程式 ;写出D溶液中的离子的电荷守恒式 .
查看习题详情和答案>>
(1)元素W是(填元素名称)
(2)Z在A中燃烧生成黑色固体颗粒和大量白烟,写出发生的化学方程式:
a 置换反应 b 化合反应 c 分解反应 d 复分解反应 e 氧化还原反应
(3)C是由X、Y、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是
(4)D是由W、X、Y 三种元素按原子个数比为1:1:2组成的一种弱酸,D在常温下为固体.D能使酸性高锰酸钾酸性溶液褪色,说明D具有
天宫一号(Tiangong-1)是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步.天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程.
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+S+3C═K2S+N2↑+3CO2↑.
①写出K2S的电子式: ;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式: ;
实验二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊后又变澄清.请设计实验方案证明该澄清溶液中含有Cl-: ;
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂.高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式: ;
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等.火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧.偏二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为 ;
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式: ;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式: .
查看习题详情和答案>>
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+S+3C═K2S+N2↑+3CO2↑.
①写出K2S的电子式:
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
实验二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊后又变澄清.请设计实验方案证明该澄清溶液中含有Cl-:
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂.高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式:
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等.火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧.偏二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式:
如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(碘化钾淀粉溶液)、D(水)、F(紫色石蕊试液).
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为
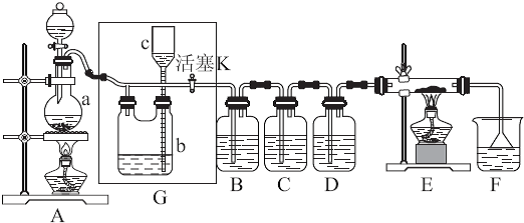
(2)G中b瓶内宜加入的液体是
(3)实验开始后B中的现象是
(4)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:
(5)在F中,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
查看习题详情和答案>>
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||

(2)G中b瓶内宜加入的液体是
饱和食盐水
饱和食盐水
,怎样检验装置G的气密性:用止水夹夹住A、G之间的胶管,关闭G中活塞K,从c中向容器内加液体,当c的下端浸入液面且c中液面高于b瓶内液面,静置一段时间,若c中液面不下降,则说明气密性好
用止水夹夹住A、G之间的胶管,关闭G中活塞K,从c中向容器内加液体,当c的下端浸入液面且c中液面高于b瓶内液面,静置一段时间,若c中液面不下降,则说明气密性好
.(3)实验开始后B中的现象是
上部空间由无色变黄绿色,溶液中有浅黄色沉淀生成
上部空间由无色变黄绿色,溶液中有浅黄色沉淀生成
,C中的现象是上部空间由无色变为黄绿色,溶液变蓝色
上部空间由无色变为黄绿色,溶液变蓝色
.(4)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:
C+2H2O+2Cl2
CO2+4HCl
| ||
C+2H2O+2Cl2
CO2+4HCl
.
| ||
(5)在F中,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
E中生成的酸性气体进入F中可使紫色石蕊试液变红,但未反应完的氯气进入F中与水作用生成HClO,HClO具有漂白作用,使溶液的红色褪去
E中生成的酸性气体进入F中可使紫色石蕊试液变红,但未反应完的氯气进入F中与水作用生成HClO,HClO具有漂白作用,使溶液的红色褪去
.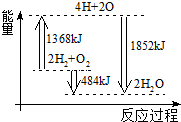 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )
如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )