题目内容
原子序数从小到大排列的四种短周期元素W、X、Y、Z,四种元素的原子最外层电子数之和等于13;W是原子半径最小的元素;由X、Y元素可组成非极性分子A,A在常温下为气体; 可以通过电解熔融Z的氯化物提取单质Z;B为浅黄色固体物质,且A与B反应可生成Y2气体.
(1)元素W是(填元素名称) ;写出B的电子式
(2)Z在A中燃烧生成黑色固体颗粒和大量白烟,写出发生的化学方程式: 该反应属于 (填写序号)
a 置换反应 b 化合反应 c 分解反应 d 复分解反应 e 氧化还原反应
(3)C是由X、Y、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是 ;试从结构的角度解释该物质比CaCO3更易分解的原因
(4)D是由W、X、Y 三种元素按原子个数比为1:1:2组成的一种弱酸,D在常温下为固体.D能使酸性高锰酸钾酸性溶液褪色,说明D具有 性,写出化学反应方程式 ;写出D溶液中的离子的电荷守恒式 .
(1)元素W是(填元素名称)
(2)Z在A中燃烧生成黑色固体颗粒和大量白烟,写出发生的化学方程式:
a 置换反应 b 化合反应 c 分解反应 d 复分解反应 e 氧化还原反应
(3)C是由X、Y、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是
(4)D是由W、X、Y 三种元素按原子个数比为1:1:2组成的一种弱酸,D在常温下为固体.D能使酸性高锰酸钾酸性溶液褪色,说明D具有
分析:原子序数从小到大排列的四种短周期元素W、X、Y、Z,W是原子半径最小的元素,则W为H元素;由X、Y元素可组成非极性分子A,A在常温下为气体,B为浅黄色固体物质,且A与B反应可生成Y2气体,应是过氧化钠与二氧化碳反应生成氧气,则A为CO2、B为Na2O2,故X为C元素、Y为O元素;四种元素的原子最外层电子数之和等于13,故Z的最外层电子数为13-1-4-6=2,Z原子序数大于O元素,故Z为Mg元素,据此解答.
解答:解:原子序数从小到大排列的四种短周期元素W、X、Y、Z,W是原子半径最小的元素,则W为H元素;由X、Y元素可组成非极性分子A,A在常温下为气体,B为浅黄色固体物质,且A与B反应可生成Y2气体,应是过氧化钠与二氧化碳反应生成氧气,则A为CO2、B为Na2O2,故X为C元素、Y为O元素;四种元素的原子最外层电子数之和等于13,故Z的最外层电子数为13-1-4-6=2,Z原子序数大于O元素,故Z为Mg元素,
(1)由上述分析可知,W为氢元素;B为Na2O2,其电子式为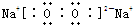 ,
,
故答案为:氢;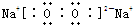 ;
;
(2)Mg在CO2中燃烧生成黑色固体颗粒和大量白烟,该反应化学方程式为:2Mg+CO2
2MgO+C,该反应属于置换反应、氧化还原反应,
故答案为:2Mg+CO2
2MgO+C;ae;
(3)C是由C、O、Mg三种元素组成的盐,能与盐酸反应生成CO2,则C的化学式是MgCO3;MgO的晶格能比CaO大,MgCO3分解产物更稳定,故比CaCO3更易分解,
故答案为:MgCO3;MgO的晶格能比CaO大,MgCO3分解产物更稳定;
(4)D是由H、C、O三种元素按原子个数比为1:1:2组成的一种弱酸为H2C2O4,能使酸性高锰酸钾酸性溶液褪色,说明D具有还原性,该反应反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;H2C2O4溶液中的离子的电荷守恒式为:c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),
故答案为:还原;5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-).
(1)由上述分析可知,W为氢元素;B为Na2O2,其电子式为
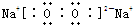 ,
,故答案为:氢;
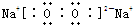 ;
;(2)Mg在CO2中燃烧生成黑色固体颗粒和大量白烟,该反应化学方程式为:2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
(3)C是由C、O、Mg三种元素组成的盐,能与盐酸反应生成CO2,则C的化学式是MgCO3;MgO的晶格能比CaO大,MgCO3分解产物更稳定,故比CaCO3更易分解,
故答案为:MgCO3;MgO的晶格能比CaO大,MgCO3分解产物更稳定;
(4)D是由H、C、O三种元素按原子个数比为1:1:2组成的一种弱酸为H2C2O4,能使酸性高锰酸钾酸性溶液褪色,说明D具有还原性,该反应反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;H2C2O4溶液中的离子的电荷守恒式为:c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),
故答案为:还原;5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-).
点评:本题考查结构性质位置关系综合应用,推断元素是关键,注意熟悉掌握常见的化合物的性质与特殊反应.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
某研究性学习小组以元素周期律为课题研究“短周期元素在周期表中的分布”,他们提出四种方案




这四种方案都有“合理”的理由,你认为下列因果关系正确的是
| 选项 | 因 | 果 |
| A | 横行:按原子序数从小到大排列 纵列:按原子序数从小到大排列 | 表二合理 |
| B | 已制得活泼金属氢化物如KH | 表四合理 |
| C | 最高正价与最低负价的绝对值相等 | 表三合理 |
| D | 原子最外层电子数相等 | 表一合理 |
