网址:http://m.1010jiajiao.com/timu_id_307517[举报]
下列反应适用于实验室制备氧气的是
①高锰酸钾热分解
2KMnO4 K2MnO4+MnO2+
O2↑
K2MnO4+MnO2+
O2↑
②硝酸铵热分解
2NH4NO3 4H2O+2N2↑+ O2↑
4H2O+2N2↑+ O2↑
③过氧化氢催化分解 2H2O2 2H2O +O2↑
2H2O +O2↑
④二氧化氮热分解
2NO2  2NO+
O2↑
2NO+
O2↑
A.只有① B.①和② C.①和③ D.①③④
查看习题详情和答案>>
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2 21℃、NO -152℃
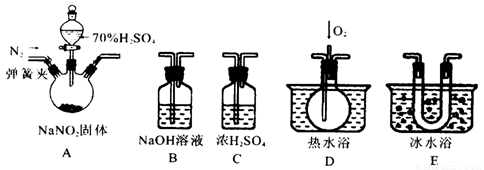
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.
查看习题详情和答案>>
(14分)I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O (l)4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
① 此合成反应的a 0 (填“>”“<”或“=”)
② 已知:
N2 (g) + 3H2(g)2NH3 (g) ΔH=-92.4 kJ·mol-1,
2H2 (g)+ O2 (g)===2H2O (l) ΔH=-571.6 kJ·mol-1,
则2N2 (g) + 6H2O (l)4NH3 (g) + 3O2 (g) ΔH= ;
(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是 (填字母标号)
II.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g)2SO3 (g) ΔH=-196.0 kJ·mol-1
① 容器体积不变时,为了提高SO2的转化率,可采用的措施是 (填字母标号)
A.加入V2O5作催化剂 B.使用过量SO2 C.高温 D.通入过量空气
② 某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是 ,该温度下的平衡常数K= ;
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将 (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将 。
查看习题详情和答案>>
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
|
 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K= ▲ 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K= ▲ 。(计算结果保留小数点后两位数字) ⑵一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。
(已知:T1<T2)
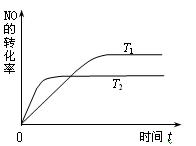
①反应 2NO(g)
 N2(g)+O2(g)为(填“吸热”或“放热”) ▲ 反应。
N2(g)+O2(g)为(填“吸热”或“放热”) ▲ 反应。②一定温度下,能够说明反应 2NO(g)
 N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。
N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。a.容器内的压强不发生变化 b.NO分解的速率和NO生成的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
⑶①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= ▲ 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 ▲ 。 查看习题详情和答案>>
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=________。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因 。
(4)吸收塔中发生反应的化学方程式为:
。
(5)上述工业流程中,采用了循环操作工艺的是 (填序号)
(6)硝酸厂的尾气含有氮氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_____________________________。 查看习题详情和答案>>