��Ŀ����
��14�֣�I����ѧ��һֱ�����ڡ��˹��̵������·����о���
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��2N2 (g)+6H2O (l)4NH3 (g)+3O2 (g) ��H�� a kJ��mol��1
��һ���о�NH3���������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������±���
| �¶� T/K | 303 | 313 | 323 |
| NH3������/(10��6 mol) | 4.8 | 5.9 | 6.0 |
�� �˺ϳɷ�Ӧ��a 0 (���������������)
�� ��֪��
N2 (g) + 3H2(g)2NH3 (g) ��H����92.4 kJ��mol��1��
2H2 (g)+ O2 (g)===2H2O (l) ��H����571.6 kJ��mol��1��
��2N2 (g) + 6H2O (l)4NH3 (g) + 3O2 (g) ��H�� ��
��2����ˮϡ��0.1 mol��L��1��ˮ����Һ������ˮ�������Ӷ���С���� ������ĸ��ţ�
II����ҵ�����в�����SO2�ķ�������ʯ�����պ��������Ƴ�����ƣ��������һ����;�dz��㷺�IJ�Ʒ���������������ᡢˮ��ȡ�
��1�����������У�SO2��������SO3���Ȼ�ѧ����ʽΪ��
2SO2 (g) + O2(g)2SO3 (g) ��H����196.0 kJ��mol��1
�� �����������ʱ��Ϊ�����SO2��ת���ʣ��ɲ��õĴ�ʩ�� ������ĸ��ţ�
A������V2O5������ B��ʹ�ù���SO2 C������ D��ͨ���������
�� ij�¶�ʱ����һ���ݻ�Ϊ10L���ܱ������г���4.0 molSO2��2.0 molO2������Ӻ�ﵽƽ�⣬���ų�352.8kJ����������ʱSO2��ת������ �����¶��µ�ƽ�ⳣ��K�� ��
��2����֪25��ʱ��Ksp(CaSO4)��7.10��10��5����0.100 L ��CaSO4�������Һ�м���2.22 gCaCl2 ��ĩ��ֽ��裬������Һ������仯���Բ��ƣ�����Һ��CaSO4����������� (���������С�����䡱����ͬ)��Ksp(CaSO4)�� ��
��14�֣�
I����1���� �� (1��) �� 1530 kJ��mol��1(2��)��2��BD (2��)
II���� D (1��) �� 90% (3��) 4050 (3��)
��2��3.55 ��10��4 (2��)
����:

 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д���14�֣�I����ѧ��һֱ�����ڡ��˹��̵������·����о���
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ��H��a kJ��mol��1
4NH3 (g)+3O2 (g) ��H��a kJ��mol��1
��һ���о�NH3���������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������±���
| �¶�T/K | 303 | 313 | 323 |
| NH3������/(10��6 mol) | 4.8 | 5.9 | 6.0 |
 ������������)
������������)����֪��
N2 (g) + 3H2(g)
 2NH3 (g) ��H����92.4kJ��mol��1��
2NH3 (g) ��H����92.4kJ��mol��1��2H2 (g) + O2 (g)===2H2O (l) ��H����571.6kJ��mol��1��
��2N2 (g) + 6H2O(l)
 4NH3 (g) + 3O2 (g) ��H�� ��
4NH3 (g) + 3O2 (g) ��H�� ����2����ˮϡ��0.1 mol��L��1��ˮ����Һ������ˮ�������Ӷ���С���� ������ĸ��ţ�
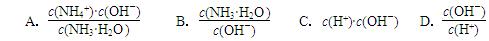
II����ҵ�����в�����SO2�ķ�������ʯ�����պ��������Ƴ�����ƣ��������һ����;�dz��㷺�IJ�Ʒ���������������ᡢˮ��ȡ�
��1�����������У�SO2��������SO3���Ȼ�ѧ����ʽΪ��
2SO2 (g) + O2(g)
 2SO3 (g) ��H����196.0kJ��mol��1
2SO3 (g) ��H����196.0kJ��mol��1�������������ʱ��Ϊ�����SO2��ת���ʣ��ɲ��õĴ�ʩ�� ������ĸ��ţ�
| A������V2O5������ | B��ʹ�ù���SO2 | C������ | D��ͨ��������� |
��2����֪25��ʱ��Ksp(CaSO4)��7.10��10��5����0.100 L ��CaSO4�������Һ�м���2.22 gCaCl2 ��ĩ��ֽ��裬������Һ������仯���Բ��ƣ�����Һ��CaSO4����������� (���������С�����䡱����ͬ)��Ksp(CaSO4)�� ��
��14�֣�I����ѧ��һֱ�����ڡ��˹��̵������·����о���
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) ��H�� a kJ��mol��1
4NH3 (g)+3O2 (g) ��H�� a kJ��mol��1
��һ���о�NH3���������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������±���
|
�¶� T/K |
303 |
313 |
323 |
|
NH3������/(10��6 mol) |
4.8 |
5.9 |
6.0 |
�� �˺ϳɷ�Ӧ��a 0 (���������������)
�� ��֪��
N2 (g) + 3H2(g) 2NH3 (g) ��H����92.4 kJ��mol��1��
2NH3 (g) ��H����92.4 kJ��mol��1��
2H2 (g) + O2 (g)===2H2O (l) ��H����571.6 kJ��mol��1��
��2N2 (g) + 6H2O (l) 4NH3 (g) + 3O2 (g) ��H��
��
4NH3 (g) + 3O2 (g) ��H��
��
��2����ˮϡ��0.1 mol��L��1��ˮ����Һ������ˮ�������Ӷ���С���� ������ĸ��ţ�

II����ҵ�����в�����SO2�ķ�������ʯ�����պ��������Ƴ�����ƣ��������һ����;�dz��㷺�IJ�Ʒ���������������ᡢˮ��ȡ�
��1�����������У�SO2��������SO3���Ȼ�ѧ����ʽΪ��
2SO2 (g) + O2(g) 2SO3 (g) ��H����196.0 kJ��mol��1
2SO3 (g) ��H����196.0 kJ��mol��1
�� �����������ʱ��Ϊ�����SO2��ת���ʣ��ɲ��õĴ�ʩ�� ������ĸ��ţ�
A������V2O5������ B��ʹ�ù���SO2 C������ D��ͨ���������
�� ij�¶�ʱ����һ���ݻ�Ϊ10L���ܱ������г���4.0 molSO2��2.0 molO2������Ӻ�ﵽƽ�⣬���ų�352.8kJ����������ʱSO2��ת������ �����¶��µ�ƽ�ⳣ��K�� ��
��2����֪25��ʱ��Ksp(CaSO4)��7.10��10��5����0.100 L ��CaSO4�������Һ�м���2.22 gCaCl2 ��ĩ��ֽ��裬������Һ������仯���Բ��ƣ�����Һ��CaSO4����������� (���������С�����䡱����ͬ)��Ksp(CaSO4)�� ��
I����ѧ��һֱ�����ڡ��˹��̵������·����о���
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��2N2 (g)+6H2O (l)![]() 4NH3 (g)+3O2 (g) ��H�� a kJ��mol��1
4NH3 (g)+3O2 (g) ��H�� a kJ��mol��1
��һ���о�NH3���������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������±���
| �¶� T/K | 303 | 313 | 323 |
| NH3������/(10��6 mol) | 4.8 | 5.9 | 6.0 |
 ��2010?�ijǶ�ģ��I����ѧ��һֱ�����ڡ��˹��̵������·����о���
��2010?�ijǶ�ģ��I����ѧ��һֱ�����ڡ��˹��̵������·����о���