摘要:(2)析出晶体后.余下508.7g饱和溶液.从90℃降温至40℃将析出晶体多少克.</PGN0037.TXT/PGN>
网址:http://m.1010jiajiao.com/timu_id_287068[举报]
某化学学习兴趣小组,为了研究晶体的结构和性质,查阅了一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4)?H2O相关资料:
一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4)?H2O为蓝色正交晶体,常温下,它易溶于水,受热分解产生氨气和硫酸铜,易与空气中的二氧化碳、水反应生成铜的碱式盐,使晶体变成绿色粉末.
它的制备原理是利用硫酸铜溶液和氨水反应生成,其晶体的析出一般不宜用蒸发浓缩等常规方法.析出晶体方法:向硫酸铜溶液中加入浓氨水后,再加入浓乙醇溶液使晶体析出.
请回答下列问题:
(1)请写出制备硫酸四氨合铜(Ⅱ)的反应方程式:
(2)析出晶体不用蒸发浓缩方法的原因是
(3)硫酸四氨合铜属于配合物,晶体中Cu2+与NH3之间的键型为
(4)请你设计实验方案探究确定SO2-4为配合物外界.
查看习题详情和答案>>
一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4)?H2O为蓝色正交晶体,常温下,它易溶于水,受热分解产生氨气和硫酸铜,易与空气中的二氧化碳、水反应生成铜的碱式盐,使晶体变成绿色粉末.
它的制备原理是利用硫酸铜溶液和氨水反应生成,其晶体的析出一般不宜用蒸发浓缩等常规方法.析出晶体方法:向硫酸铜溶液中加入浓氨水后,再加入浓乙醇溶液使晶体析出.
请回答下列问题:
(1)请写出制备硫酸四氨合铜(Ⅱ)的反应方程式:
CuSO4+4NH3+H2O=[Cu(NH3)4]SO4?H2O
CuSO4+4NH3+H2O=[Cu(NH3)4]SO4?H2O
.(2)析出晶体不用蒸发浓缩方法的原因是
[Cu(NH3)4]SO4?H2O受热分解
[Cu(NH3)4]SO4?H2O受热分解
;其中乙醇的作用是硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度或减小水的极性
硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度或减小水的极性
.(3)硫酸四氨合铜属于配合物,晶体中Cu2+与NH3之间的键型为
配位键
配位键
,该化学键能够形成的原因是NH3能提供孤对电子,Cu2+能接受孤对电子(或有空轨道)
NH3能提供孤对电子,Cu2+能接受孤对电子(或有空轨道)
.(4)请你设计实验方案探究确定SO2-4为配合物外界.
取硫酸四氨合铜晶体溶于水配成溶液,向溶液中加入适量的Ba(NO3)2溶液,溶液中出现白色沉淀,说明溶液中有SO42-存在于外界
取硫酸四氨合铜晶体溶于水配成溶液,向溶液中加入适量的Ba(NO3)2溶液,溶液中出现白色沉淀,说明溶液中有SO42-存在于外界
.把CO2通入浓的NaOH溶液中,反应开始时反应的离子方程式为 ;若继续通入CO2直至过量,则有细小晶体析出,其反应的化学方程式为 ;然后将析出晶体后的溶液分成2等份,分别滴入少量下列溶液,反应的离子方程式为:
(1)NaOH溶液: ;
(2)HCl溶液: .
查看习题详情和答案>>
(1)NaOH溶液:
(2)HCl溶液:
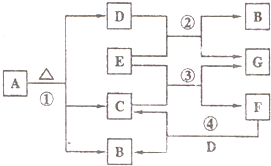 已知固体A的焰色反应呈黄色、D、G在常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系.
已知固体A的焰色反应呈黄色、D、G在常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系. 回答下列问题:
(1)写出下列物质的化学式:
A
(2)写出反应①的化学方程式:
(3)把D通入到F的浓溶液中反应开始时的离子方程式为