网址:http://m.1010jiajiao.com/timu_id_286627[举报]
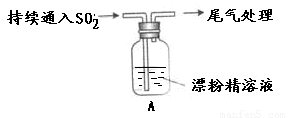
某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
| 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式?????????????????????????????? ;???
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是???????????????????????????????????????? ;
②由实验a、b不能判断白雾中含有HC1,理由是?????????????????????????????????????? ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是???????? ;
②用离子方程式解释现象iii中黄绿色褪去的原因:??????????????????????????????????? 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- == 3C1-+ IO3-
IO3- + 5I- + 3H2O == 6OH-+ 3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为????????????????????????? 。
查看习题详情和答案>>
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
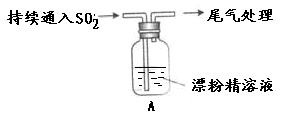 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。

(1)在高温下,装置B中发生反应的化学方程式是
| ||
| ||
(2)请在图2装置中选择满足虚线框图C的气体收集装置
(3)该小组同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
【查阅资料】该小组同学通过资料得知,固体产物中一般不会同时出现三种形态混合物组合.
【提出假设】
假设1:全部为氧化亚铁;
假设2:全部为四氧化三铁;
假设3:铁和氧化亚铁混合物;
假设4:铁和四氧化三儿混合物;
假设5:
【设计方案】小组成员讨论后对假设4提出实验方案(不要在答题卡上作答)
【实验过程】
根据上述设计的方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入适量盐酸,微热 | 黑色粉末全部溶解,溶液呈 浅绿色 浅绿色 ,有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液加几滴KSCN溶液,振荡 | 溶液不显血红色 |
②继续向Ⅱ溶液中加稀硝酸,立即出现血色,写出该过程中发生变化的离子方程式
A.Fe+HCl B.Cu+HNO3 C.H2S+O2
(2)Fe和稀HNO3反应的产物也是由相对量来控制,已知过量硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁反应,当Cl2过量时生成FeCl3,当铁粉过量时产物是FeCl2.为了验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质A,然后通过实验确定其成分.探究过程如下:
a.提出假设:
假设1:该固体物质是FeCl2;
假设2:该固体物质是FeCl3;
假设3:该固体物质是______.
b.设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解,然后取两份A溶液分别进行实验,实验现象与结论如下表
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | ______ | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |
(3)已知Fe(NO3)2溶液为浅绿色,往Fe(NO3)2溶液中加入少量的稀硫酸,溶液颜色有何变化______,该变化过程的离子方程式为______.
(4)取100mL 0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分 反应后仍有固体剩余,下列叙述一定不正确的是______(设溶液体积不变,不考虑水解因素).
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L
D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L.
查看习题详情和答案>>
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。 查看习题详情和答案>>