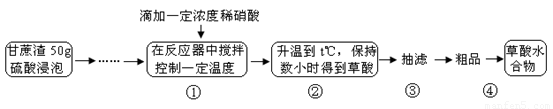
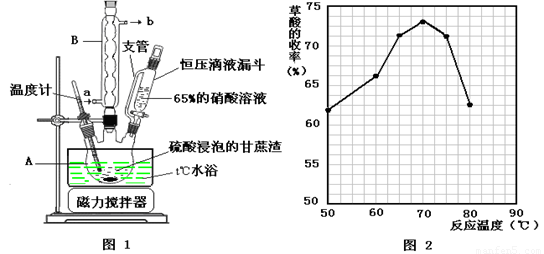
题目内容
(1)在学习过程中要善于归纳总结,同样的反应物在不同的情况下反应产物出现不同,如Na和O2反应的产物由条件控制,Zn与H2SO4反应由硫酸浓度控制,NaOH与CO2反应生成的盐由相对量控制.下列反应也可能得到不同的产物是______.A.Fe+HCl B.Cu+HNO3 C.H2S+O2
(2)Fe和稀HNO3反应的产物也是由相对量来控制,已知过量硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁反应,当Cl2过量时生成FeCl3,当铁粉过量时产物是FeCl2.为了验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质A,然后通过实验确定其成分.探究过程如下:
a.提出假设:
假设1:该固体物质是FeCl2;
假设2:该固体物质是FeCl3;
假设3:该固体物质是______.
b.设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解,然后取两份A溶液分别进行实验,实验现象与结论如下表
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | ______ | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |
(3)已知Fe(NO3)2溶液为浅绿色,往Fe(NO3)2溶液中加入少量的稀硫酸,溶液颜色有何变化______,该变化过程的离子方程式为______.
(4)取100mL 0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分 反应后仍有固体剩余,下列叙述一定不正确的是______(设溶液体积不变,不考虑水解因素).
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L
D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L.
【答案】分析:(1)反应的条件不同产物不同,浓度不同产物不同分析反应产物;
(2)a、根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
b、固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
c、依据实验现象得到结论是氯气和铁反应制生成氯化铁;
(3)NO3-在酸性条件下具有强氧化性,可与Fe2+发生氧化还原反应;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余;溶液中铁离子一定不存在;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在;
C、溶液中氯离子浓度不变;
D、溶液中铁铜都有,说明铁离子和铁反应生成亚铁离子.
解答:解:(1)A.Fe+HCl反应生成氯化亚铁和氢气,故A不符合;
B.Cu+HNO3反应,硝酸浓度不同生成产物不同,故B符合;
C.H2S+O2反应氧气量不同产物不同,氧气足量生成二氧化硫和水,氧气不足生成硫单质和水,故C符合;
故答案为:BC;
(2)a、根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl3和FeCl2;
b、固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2,
故答案为:溶液变红色;FeCl2;
c、依据实验现象和分析得到,氯气和铁反应制生成氯化铁,故答案为:氯气与铁反应只生成FeCl3;
(3)NO3-在酸性条件下具有强氧化性,可与Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,溶液由浅绿色变为黄色,
故答案为:由浅绿色变为黄色;3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余;溶液中铁离子一定不存在;2Fe3++Fe=3Fe2+;依据铁离子物质的量0.02mol生成亚铁离子0.03mol,亚铁离子浓度c(Fe2+)=0.3mol/L,故A错误;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在;依据A计算亚铁离子浓度c(Fe2+)=0.3mol/L,故B正确;
C、溶液中氯离子浓度不变;.烧杯中有Cu无Fe,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在,溶液中c(Cl-)=0.6mol/L,故C正确;
D、溶液中铁铜都有,说明铁离子和铁反应生成亚铁离子,烧杯中Fe、Cu均有,说明铁离子全部反应,依据A计算得到c(Fe2+)=0.3mol/L,故D正确;
故选A.
点评:本题考查了反应类推方法的应用,反应产物实验设计的应用,反应现象的判断,实验方案的设计,铁、铜、氯化铁溶液共存问题的分析判断离子浓度的计算,题目难度中等.
(2)a、根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
b、固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
c、依据实验现象得到结论是氯气和铁反应制生成氯化铁;
(3)NO3-在酸性条件下具有强氧化性,可与Fe2+发生氧化还原反应;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余;溶液中铁离子一定不存在;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在;
C、溶液中氯离子浓度不变;
D、溶液中铁铜都有,说明铁离子和铁反应生成亚铁离子.
解答:解:(1)A.Fe+HCl反应生成氯化亚铁和氢气,故A不符合;
B.Cu+HNO3反应,硝酸浓度不同生成产物不同,故B符合;
C.H2S+O2反应氧气量不同产物不同,氧气足量生成二氧化硫和水,氧气不足生成硫单质和水,故C符合;
故答案为:BC;
(2)a、根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl3和FeCl2;
b、固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2,
故答案为:溶液变红色;FeCl2;
c、依据实验现象和分析得到,氯气和铁反应制生成氯化铁,故答案为:氯气与铁反应只生成FeCl3;
(3)NO3-在酸性条件下具有强氧化性,可与Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,溶液由浅绿色变为黄色,
故答案为:由浅绿色变为黄色;3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余;溶液中铁离子一定不存在;2Fe3++Fe=3Fe2+;依据铁离子物质的量0.02mol生成亚铁离子0.03mol,亚铁离子浓度c(Fe2+)=0.3mol/L,故A错误;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在;依据A计算亚铁离子浓度c(Fe2+)=0.3mol/L,故B正确;
C、溶液中氯离子浓度不变;.烧杯中有Cu无Fe,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在,溶液中c(Cl-)=0.6mol/L,故C正确;
D、溶液中铁铜都有,说明铁离子和铁反应生成亚铁离子,烧杯中Fe、Cu均有,说明铁离子全部反应,依据A计算得到c(Fe2+)=0.3mol/L,故D正确;
故选A.
点评:本题考查了反应类推方法的应用,反应产物实验设计的应用,反应现象的判断,实验方案的设计,铁、铜、氯化铁溶液共存问题的分析判断离子浓度的计算,题目难度中等.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目

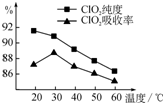 某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成