网址:http://m.1010jiajiao.com/timu_id_28429[举报]
已知在酸性溶液中的还原性强弱顺序为:SO2 >I–>H2O2>Fe2+>Cl–,下列反应不可能发生的是:
A.H2O2+ H2SO4=SO2↑+ O2↑+2 H2O
B.2I– +2Fe3+=I2+2 Fe2+
C.2Fe3++ SO2 +2H2O=2Fe2++SO42– +4H+
D.SO2 +2 H2O+ I2=H2SO4+2HI
查看习题详情和答案>>
(1)小芳认为,物质在微观上都是由微粒构成的。
铁 离子
氮气 分子
氯化钠 原子
(2)小琪认为,有些物质因结构与组成的微小差异,会使其发生很大变化。如:
H2O与H2O2 元素组成不同
黄铜与青铜 原子排列不同
金刚石与石墨 分子中原子个数不同
查看习题详情和答案>>H2O2是一种无色粘稠液体,受热易分解,沸点比水高,其水溶液呈弱酸性。工业上常用乙基蒽醌法制备H2O2:在含镍或钯的催化剂作用下,在苯溶液中用H2还原乙基蒽醌变为蒽醇,当蒽醇被氧氧化时生成过氧化氢。其转化的基本流程如下:
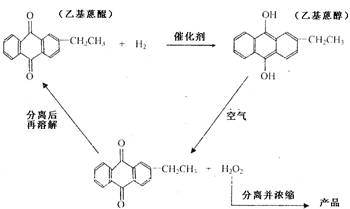
(1)实验室用稀硫酸与过氧化钡反应制取H2O2,化学方程式为 。
(2)某试剂厂先制得17%―18的H2O2溶液,再浓缩成30%溶液时,可采用的适宜方法是
(填代号)
A.常压蒸馏B.减压蒸馏C.加生石灰常压蒸馏D.加压蒸馏
(3)根据乙基蒽醌法制备过氧化氢的流程可以认为这种制备方法的实质相当于(用化学方程式表示) ,相对于实验室制法,其优点是 。
(4)科学家对H2O2结构的认识经历了漫长的过程,最初,科学家提出两种观点:
① ![]() ②H―O―O―H
②H―O―O―H
其中①式中氧氧健为配位键,即共同电子对由某原子单方面提供(在化学反应中氧氧健遇到还原剂时易断裂)。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
A.用(C2H5)2SO4与H2O2(物质的量1:1)反应,生成有机物A和H2SO4。
B.将生成的A与H2反应,(已知该反应中H2作还原剂)
①如果H2O2的结构如①所示,实验B中化学反应方程式为 ;
如果H2O2的结构如②所示,则实验B中化学反应方程式为 。
②为了进一步确定H2O2的结构,还需在实验B后添加一步实验C,请设计C的实验方案: 。
查看习题详情和答案>>(14分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料
Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 。
(3)若固体粉末完全溶解无固体存在, 滴加 KSCN 试剂时溶液不变红色, 则证明原固体粉末是 ,写出所有发生的反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矶(CuSO4 . 5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2 +、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
实验小组设计如下实验方案:
试回答:
试剂1为 ,试剂2为 (填字母序号);固体x的化学式是 。
查看习题详情和答案>>
(15分)I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 , 10C+P4O10==P4+10CO
每生成 1molP4 时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2 用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗bmolL-1 Na2S2O3溶液V2ml.该溶液中维生素C的物质量是 mol。
(4)在酸性溶液中,碘酸钠(KIO3)和亚硫酸钠可发生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
|
|
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度/℃ |
溶液出现蓝色时所需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
|
|
实验2 |
5 |
5 |
40 |
25 |
|
|
实验3 |
5 |
5 |
V2 |
0 |
|
该实验的目的是______;表中V2=_________mL.
II稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH ≈3. Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O=====□Ce(OH)4↓+□
查看习题详情和答案>>