题目内容
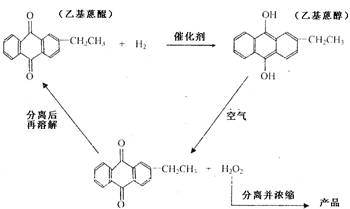
H2O2是一种无色粘稠液体,受热易分解,沸点比水高,其水溶液呈弱酸性。工业上常用乙基蒽醌法制备H2O2:在含镍或钯的催化剂作用下,在苯溶液中用H2还原乙基蒽醌变为蒽醇,当蒽醇被氧氧化时生成过氧化氢。其转化的基本流程如下:
(1)实验室用稀硫酸与过氧化钡反应制取H2O2,化学方程式为 。
(2)某试剂厂先制得17%―18的H2O2溶液,再浓缩成30%溶液时,可采用的适宜方法是
(填代号)
A.常压蒸馏B.减压蒸馏C.加生石灰常压蒸馏D.加压蒸馏
(3)根据乙基蒽醌法制备过氧化氢的流程可以认为这种制备方法的实质相当于(用化学方程式表示) ,相对于实验室制法,其优点是 。
(4)科学家对H2O2结构的认识经历了漫长的过程,最初,科学家提出两种观点:
① ![]() ②H―O―O―H
②H―O―O―H
其中①式中氧氧健为配位键,即共同电子对由某原子单方面提供(在化学反应中氧氧健遇到还原剂时易断裂)。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
A.用(C2H5)2SO4与H2O2(物质的量1:1)反应,生成有机物A和H2SO4。
B.将生成的A与H2反应,(已知该反应中H2作还原剂)
①如果H2O2的结构如①所示,实验B中化学反应方程式为 ;
如果H2O2的结构如②所示,则实验B中化学反应方程式为 。
②为了进一步确定H2O2的结构,还需在实验B后添加一步实验C,请设计C的实验方案: 。
(1)BaO2+H2SO4=BaSO4↓+H2O2
(2)B
(3)H2+O2 ![]() H2O2,①原料来源广泛,②乙基蒽醌实际上并没有被消耗,在整个流程中循环使用,符合绿色化学的思想。
H2O2,①原料来源广泛,②乙基蒽醌实际上并没有被消耗,在整个流程中循环使用,符合绿色化学的思想。
(4)①![]() +H2→C2H5―O―C2H5+H2O
+H2→C2H5―O―C2H5+H2O
C2H5-O-O-C2H5+H2→2C2H5OH
②在(1)反应中的溶液中加入无水CuSO4,若变蓝,则证明H2O2的结构为①式,否则为②式。