摘要:C. c(I)的电极反应式为:H2+2OH--2e- ===2H2O
网址:http://m.1010jiajiao.com/timu_id_283974[举报]


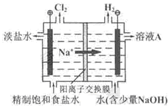 (2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
(2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.(1)溶液A的溶质是
NaOH
NaOH
.(2)电解饱和食盐水的离子方程式是
2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
.
| ||
(3)电解时用盐酸控制阳极区溶液的pH在2~3.用化学平衡移动原理解释盐酸的作用:
Cl2与水的反应为Cl2+H2O HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
 HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出Cl2与水的反应为Cl2+H2O HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
. HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出(4)电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精制流程如下(淡盐水和溶液A来自电解池):
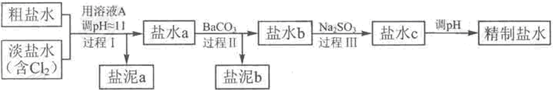
①盐泥a除泥沙外,还含有的物质是
Mg(OH)2
Mg(OH)2
.②过程I中将NH4+转化为N2的离子方程式是
2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O
2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O
.③BaSO4的溶解度比BaCO3的小.过程II中除去的离子有
SO42-、Ca2+
SO42-、Ca2+
.④经过程III处理,要求盐水c中剩余Na2SO3的含量小于5mg/L.若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10% Na2SO3溶液
1.76
1.76
kg(溶液体积变化忽略不计).铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。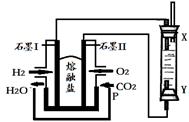
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。

①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+
 O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1 C(s)+O2(g)
 CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-12C(s)+O2(g)
 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1则高炉炼铁过程中 FeO(s)+CO(g)
 Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。

①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
常温下D、E、F、I、J为气体,H、I、J都为氧化物,J为非极性分子;C的焰色反应为黄色;M为红褐色的固体,由G分解得到的H、I、J三者的物质的量相等.下图表示各物质之间的转化关系,

试回答下列问题:
(1)写出L的化学式
(2)基于反应①原理的化学工业称为
(3)反应②的现象是
(4)写出反应③的化学方程式
(5)K溶液中加入Na2O2溶液后有红褐色沉淀和黄色溶液生成,若转移3iVA的电子,得到沉淀的质量为
查看习题详情和答案>>

试回答下列问题:
(1)写出L的化学式
Fe(OH)2
Fe(OH)2
,J的结构式O=C=O
O=C=O
(2)基于反应①原理的化学工业称为
氯碱工业
氯碱工业
,写出反应①的离子方程式:2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
(3)反应②的现象是
白色固体变为灰绿色进一步变为红褐色.
白色固体变为灰绿色进一步变为红褐色.
(4)写出反应③的化学方程式
FeC2O4
FeO+CO↑+CO2↑
| ||
FeC2O4
FeO+CO↑+CO2↑
| ||
(5)K溶液中加入Na2O2溶液后有红褐色沉淀和黄色溶液生成,若转移3iVA的电子,得到沉淀的质量为
214
214
g.某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.
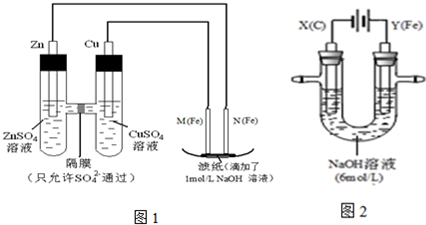
请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为
(3)实验过程中,SO42-
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-═FeO42-+4H2O和
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为
查看习题详情和答案>>

请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A
A
(填字母序号).A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为
2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-)
2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-)
.(3)实验过程中,SO42-
从右向左
从右向左
(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有滤纸上有红褐色斑点产生
滤纸上有红褐色斑点产生
.II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH
增大
增大
(填“增大”、“减小”或“不变”).(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-═FeO42-+4H2O和
4OH--4e-═2H2O+O2↑
4OH--4e-═2H2O+O2↑
.(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
0.28
0.28
g.(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为
2FeO42-+6e-+5H2O═Fe2O3+10OH-
2FeO42-+6e-+5H2O═Fe2O3+10OH-
.