摘要:CH3OH(g)==CH3OH(l) △H=-Q2kJ? mol-12CH3OH(g)+3O2 (g) === 2CO2(g)+4H2O(g) △H=-Q3kJ? mol-1 (Q1.Q2.Q3均大于0)
网址:http://m.1010jiajiao.com/timu_id_283947[举报]


下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出元素N的基态原子电子排布式
(2)元素G,H形成的单质熔点更高的是
(3)G与K形成G2K的电子式:
 .E,G,L三种元素组成的化合物含有的化学键的类型是
.E,G,L三种元素组成的化合物含有的化学键的类型是
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有
(5)A,E,K间形成的甲,乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式:
(6)M单质在高温下可与A2E反应,请写出该反应的化学反应方程式:
(7)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为
查看习题详情和答案>>
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | K | L | ||||||||||||
| M | N | ||||||||||||||||
(1)请写出元素N的基态原子电子排布式
1s22s22p63s23p63d74s2
1s22s22p63s23p63d74s2
.(2)元素G,H形成的单质熔点更高的是
Mg
Mg
(填化学式),原因是Mg2+离子所带电荷比Na+多、半径比Na+小
Mg2+离子所带电荷比Na+多、半径比Na+小
(3)G与K形成G2K的电子式:


离子键、共价键
离子键、共价键
.(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有
①③
①③
(填序号),(5)A,E,K间形成的甲,乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式:
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.(6)M单质在高温下可与A2E反应,请写出该反应的化学反应方程式:
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
(7)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为
[Co(SO4)(NH3)5]Br
[Co(SO4)(NH3)5]Br
.CO和H2作为燃料和化工原料,有着十分广泛的应用.
(1)已知:C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
C(s)+H2O(g)═CO(g)十H2(g)△H2=+131.3kJ?mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)的△H= kJ?mol-1
标准状况下33.6L CO、H2的混合气体与足量氧气充分反应生成CO2和H2O,反应过程中转移电子
mol.
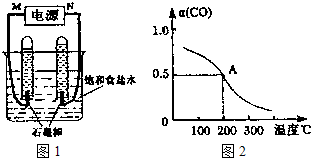
(2)利用反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图1所示.则①M应是电源的 极(填“正”或“负”);②该电解反应的化学方程式是 ;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为 .
(3)在一密闭容器中充入10mol CO与20mol H2,一定条件下可反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)l CO的转化率(α)与温度的关系如图2所示.
①测得A点时容器的体积为10L.该温度下的平衡常数K= .
②在不改变反应物用量的情况下,为提高CO转化率可采取的措施是 .
查看习题详情和答案>>

(1)已知:C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
C(s)+H2O(g)═CO(g)十H2(g)△H2=+131.3kJ?mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)的△H=
标准状况下33.6L CO、H2的混合气体与足量氧气充分反应生成CO2和H2O,反应过程中转移电子
mol.
(2)利用反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图1所示.则①M应是电源的
(3)在一密闭容器中充入10mol CO与20mol H2,一定条件下可反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)l CO的转化率(α)与温度的关系如图2所示.
①测得A点时容器的体积为10L.该温度下的平衡常数K=
②在不改变反应物用量的情况下,为提高CO转化率可采取的措施是
(1)有机物M经过太阳光照可转化成N,转化过程如下:
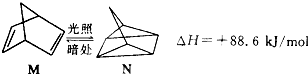
则M、N相比,较稳定的是
(2)已知CH3OH(l)的燃烧热△H=-238.6kJ/mol,CH3OH(l)+
O2(g)═CO2(g)+2H2(g)△H=-akJ/mol
则a
(3)将CH3OH设计成燃料电池,KOH溶液为电解质溶液,则通CH3OH气体的电极为电池的
(4)断裂1mol化学键所需的能量见下表:
常温下,N2与H2O反应生成NH3的热化学方程式为:
查看习题详情和答案>>
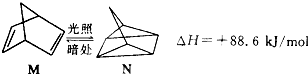
则M、N相比,较稳定的是
M
M
.(2)已知CH3OH(l)的燃烧热△H=-238.6kJ/mol,CH3OH(l)+
| 1 |
| 2 |
则a
<
<
(填“>”、“<”或“=”)238.6.(3)将CH3OH设计成燃料电池,KOH溶液为电解质溶液,则通CH3OH气体的电极为电池的
负
负
极,该电极反应式为CH3OH-6e-+8OH-=C032-+6H2O
CH3OH-6e-+8OH-=C032-+6H2O
.(4)断裂1mol化学键所需的能量见下表:
| 共价键 | H-N | H-O | N≡N | O=O |
| 断裂1mol化学键所需能量/kJ/mol | 393 | 460 | 941 | 499 |
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1189KJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1189KJ/mol
.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ?mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ?mol-1
下列说法正确的是( )
A、反应①中的能量变化如图所示 | ||
| B、CH3OH的燃烧热为192.9kJ?mol-1 | ||
| C、CH3OH转变成H2的过程一定要吸收能量 | ||
D、根据②推知反应:CH3OH(l)+
|
近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注。该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景。已知4.4 g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95 kJ的能量。
(1)该反应的热化学方程式为:__________________________________________.
(2)在270℃、8 MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48 m3(已折合为标准状况)的CO2在合成CH3OH气体过程中能放出热量________ kJ.
(3)又已知H2O(g)===H2O(l) ΔH=-44 kJ/mol,则CO2气体与H2气体反应生成CH3OH气体16g和液态水时放出热量为 kJ.