题目内容
CO和H2作为燃料和化工原料,有着十分广泛的应用.
(1)已知:C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
C(s)+H2O(g)═CO(g)十H2(g)△H2=+131.3kJ?mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)的△H= kJ?mol-1
标准状况下33.6L CO、H2的混合气体与足量氧气充分反应生成CO2和H2O,反应过程中转移电子
mol.
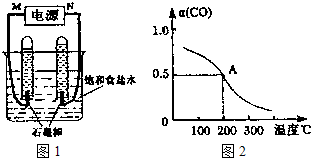
(2)利用反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图1所示.则①M应是电源的 极(填“正”或“负”);②该电解反应的化学方程式是 ;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为 .
(3)在一密闭容器中充入10mol CO与20mol H2,一定条件下可反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)l CO的转化率(α)与温度的关系如图2所示.
①测得A点时容器的体积为10L.该温度下的平衡常数K= .
②在不改变反应物用量的情况下,为提高CO转化率可采取的措施是 .

(1)已知:C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
C(s)+H2O(g)═CO(g)十H2(g)△H2=+131.3kJ?mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)的△H=
标准状况下33.6L CO、H2的混合气体与足量氧气充分反应生成CO2和H2O,反应过程中转移电子
mol.
(2)利用反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图1所示.则①M应是电源的
(3)在一密闭容器中充入10mol CO与20mol H2,一定条件下可反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)l CO的转化率(α)与温度的关系如图2所示.
①测得A点时容器的体积为10L.该温度下的平衡常数K=
②在不改变反应物用量的情况下,为提高CO转化率可采取的措施是
分析:(1)根据①C(s)+O2 (g)═CO2(g)△H1=-393.5kJ?mol-1;②C(s)+H2O(g)═CO(g)+H2(g)△H3=+131.3kJ?mol-1两个热化学方程式,利用盖斯定律,将①-②可得反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)的反应热,根据CO、H2参加的量计算转移的电子数目;
(2)用惰性电极电解饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气;溶液中水的电离被促进生成氢氧化钠;电解NaCl结束后,再电解水2H2O
2H2↑+O2↑;用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;根据氯气和氢氧化钠的关系式计算氢氧化钠的物质的量浓度,从而得出溶液的pH;
(3)①根据图象判断出A点时的各种物质的浓度,用平衡常数的表达式进行计算;
②根据反应的特征可从温度、压强、浓度等因素改变条件使平衡向正方向移动,从而提高转化率;
(2)用惰性电极电解饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气;溶液中水的电离被促进生成氢氧化钠;电解NaCl结束后,再电解水2H2O
| ||
(3)①根据图象判断出A点时的各种物质的浓度,用平衡常数的表达式进行计算;
②根据反应的特征可从温度、压强、浓度等因素改变条件使平衡向正方向移动,从而提高转化率;
解答:解:(1)根据①C(s)+O2 (g)═CO2(g)△H1=-393.5kJ?mol-1;②C(s)+H2O(g)═CO(g)+H2(g)△H3=+131.3kJ?mol-1两个热化学方程式,
利用盖斯定律,将①-②可得反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g),△H=-393.5kJ?mol-1-131.3kJ?mol-1=-524.83kJ?mol-1,
CO、H2与氧气反应的方程式分别为:2CO++O2
2CO2;2H2+O2
2H2O,从
方程式可以看出相同物质的量的CO、H2燃烧转移的电子数目相等,所以标准状况下CO、H233.6L与氧气反应生成CO2和H2O转移的电子的物质的量为:
=3mol,
故答案为:-524.8; 3;
(2)①用惰性电极电解饱和食盐水,阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气;溶液中水的电离被促进生成氢氧化钠;电解NaCl结束后,再电解水2H2O
2H2↑+O2↑,根据图示1反应装置及现象可知M极连接的试管生成的气体多,应是电源的负极,
②用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中还生成氢氧化钠,所以电池反应式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
③测得左侧试管中气体体积为11.2mL为氢气,设氢氧化钠的物质的量浓度是xmol/L,
2NaCl+2H2O
2NaOH+H2↑+Cl2↑,转移的电子 生成的氢氧化钠
22.4L 2mol 2mol
0.0112L xmol Xmol
x=
=0.001mol,已知饱和食盐水的体积为1L,电解前后溶液的体积变化忽略不计,则C(H+)=
=
mol/L=10-11mol/L,PH=-lgc(H+)=11,
故答案为:负;2NaCl+2H2O
2NaOH+H2↑+Cl2↑; 11;
(3)①根据图象可以看出,A点时CO的转化率为50%,10mol CO转化5mol,测得A点时容器的体积为10L,则平衡时各物质的量浓度为:c(CO)=0.5mol/L;c(H2)=1mol/L;c(CH3OH)=0.5mol/L;所以平衡常数为=
=
(mol?L-1)-2=1(mol?L-1)-2,
故答案为:1(mol?L-1)-2;
②提高转化率应使平衡向正反应方向移动,根据反应方程式的特征可明显判断出可采取的措施为:降温、加压,将甲醇从混合体系中分离出来,
故答案为:降温、加压,将甲醇从混合体系中分离出来;
利用盖斯定律,将①-②可得反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g),△H=-393.5kJ?mol-1-131.3kJ?mol-1=-524.83kJ?mol-1,
CO、H2与氧气反应的方程式分别为:2CO++O2
| ||
| ||
方程式可以看出相同物质的量的CO、H2燃烧转移的电子数目相等,所以标准状况下CO、H233.6L与氧气反应生成CO2和H2O转移的电子的物质的量为:
| 33.6L |
| 22.4L/mol |
故答案为:-524.8; 3;
(2)①用惰性电极电解饱和食盐水,阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气;溶液中水的电离被促进生成氢氧化钠;电解NaCl结束后,再电解水2H2O
| ||
②用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中还生成氢氧化钠,所以电池反应式为2NaCl+2H2O
| ||
③测得左侧试管中气体体积为11.2mL为氢气,设氢氧化钠的物质的量浓度是xmol/L,
2NaCl+2H2O
| ||
22.4L 2mol 2mol
0.0112L xmol Xmol
x=
| 2mol×0.0112L |
| 22.4L |
| KW |
| C(OH-) |
| 10-14 |
| 10-3 |
故答案为:负;2NaCl+2H2O
| ||
(3)①根据图象可以看出,A点时CO的转化率为50%,10mol CO转化5mol,测得A点时容器的体积为10L,则平衡时各物质的量浓度为:c(CO)=0.5mol/L;c(H2)=1mol/L;c(CH3OH)=0.5mol/L;所以平衡常数为=
| c(CH3OH) |
| c(CO)×c2(H2) |
| 0.5 |
| 12×0.5 |
故答案为:1(mol?L-1)-2;
②提高转化率应使平衡向正反应方向移动,根据反应方程式的特征可明显判断出可采取的措施为:降温、加压,将甲醇从混合体系中分离出来,
故答案为:降温、加压,将甲醇从混合体系中分离出来;
点评:本题较为综合,从多个角度考查盖斯定律、电解池原理、溶液的pH计算、化学平衡等知识,正确推断原电池正负极是解本题的关键,难点是计算溶液的pH,题目难度中等.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ? ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ? ΔH 2 = ?41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ? ΔH 3 = ?206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式??????????????????????????????????? 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有???????????????????? 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式?????????????????????? 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
实验编号 | 容器体积/L | 温度/°C |
① | 2.0 | 1200 |
② | 2.0 | 1300 |
③ | 1.0 | 1200 |
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。

(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1(反应1)该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为: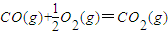 △H2=-283kJ?mol-1(反应2)
△H2=-283kJ?mol-1(反应2)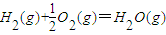 △H3=-242kJ?mol-1(反应3)
△H3=-242kJ?mol-1(反应3)
某些化学键的键能数据如下表:
请回答下列问题:
(1)反应1的焓变△H1= .
(2)CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:CH3OH(g)+ O2(g)═CO2(g)+2H2O(g)△H4 该反应的焓变△H4= .与CO和H2相比,甲醇作为汽车动力燃料的优点是 .
O2(g)═CO2(g)+2H2O(g)△H4 该反应的焓变△H4= .与CO和H2相比,甲醇作为汽车动力燃料的优点是 .
(3)反应1的平衡常数表达式为 .为提高甲醇的产率,可以采取的措施有 (写出3点).既能提高产率,又能提高反应速率的措施是 .
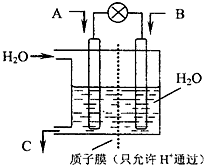
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+ O2(g)═CO2(g)+2H2O(l).其工作原理如示意图:
O2(g)═CO2(g)+2H2O(l).其工作原理如示意图:
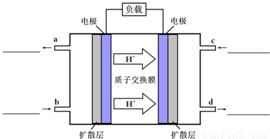
①在图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 .
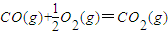 △H2=-283kJ?mol-1(反应2)
△H2=-283kJ?mol-1(反应2)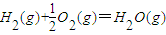 △H3=-242kJ?mol-1(反应3)
△H3=-242kJ?mol-1(反应3)某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)反应1的焓变△H1= .
(2)CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:CH3OH(g)+
 O2(g)═CO2(g)+2H2O(g)△H4 该反应的焓变△H4= .与CO和H2相比,甲醇作为汽车动力燃料的优点是 .
O2(g)═CO2(g)+2H2O(g)△H4 该反应的焓变△H4= .与CO和H2相比,甲醇作为汽车动力燃料的优点是 .(3)反应1的平衡常数表达式为 .为提高甲醇的产率,可以采取的措施有 (写出3点).既能提高产率,又能提高反应速率的措施是 .
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+
 O2(g)═CO2(g)+2H2O(l).其工作原理如示意图:
O2(g)═CO2(g)+2H2O(l).其工作原理如示意图:
①在图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 .

 (2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
(2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.