网址:http://m.1010jiajiao.com/timu_id_276924[举报]
题号
6
7
8
9
10
11
12
13
答案
B
B
B
D
D
C
A
D
26.(共14分)(1)ABC(3分)
(2)铝、镁、硅、碳(4分)
(3)不一定(1分);混合后的溶液可能是强酸性也可能是强碱性,不能保证一定有Al(OH)3生成。(3分)
(4)Mg的物质的量是Si的2倍。(3分)
27. (共15分)(1)第五周期,ⅣA族。(2分)
(2) (3分)
(3分)
(3)Sn+2H+=H2↑+Sn2+ (2分)
(4)①取一小片pH试纸,放在干燥洁净的玻璃片上,用玻璃棒蘸取待测溶液点在试纸上,然后与标准比色卡对照,读取pH。 (3分)
②将SnCl4溶解在较浓的盐酸溶液中,然后用蒸馏水稀释到所需的倍数。(3分)
③大于 (2分)
28.(共16分,每空2分)
(1)甲、丁 生成CO2气体残留在装置中
(2)① c ② 将装置中残留的CO2气体吹出;防止溶液发生倒吸
(3)无尾气处理装置
(4)①2Al+2NaOH+2H2O=2NaAlO+3H2↑ ②2Fe2++H2O2+2H+=2Fe3++2H2O
③5.28
29.(15分)
(1)a d(2分)
 (2)醛基(2分); CH3CH2COOH(2分)
(2)醛基(2分); CH3CH2COOH(2分)
(3)CH3(CH2)4COOH+CH2=CHCH2OH
CH3(CH2)4COOCH2CH=CH2+H2O
(3分)
(4)(CH3)3CCH2OOCH(3分)

(5) (3分)
唐山一中2009届高三年级仿真训练考试(一)
理科综合能力测试
生物部分参考答案
题号
1
2
3
4
5
答案
C
D
D
B
D
30.(20分)
Ⅰ.(7分,每空1分)(1)效应器;神经中枢 (2)0;2 (3)兴奋在细胞之间的传递 (4)X、Y;Y
Ⅱ.(13分)
(1)乳酸(2分); (3分);
(3分); (2分)
(2分)
(2)A(2分)
(3)运动后肌肉酸痛主要是乳酸在肌肉里积累(2分),轻微的调整性运动和热敷能加快血液循环把肌肉细胞中的乳酸运送到肝细胞转变成丙酮酸,丙酮酸氧化分解释放能量或转变成肝糖元或葡萄糖(2分)。
31.(每空2分,共计22分)
(1)一;减数第二次分裂后期两条XX没有分开
(2)E或e;基因的分离 (3)50%;100%
(4)实验步骤:腿部无斑纹;腿部有斑纹;用亲本果蝇进行杂交
结果分析:腿部有斑纹;腿部无斑纹
唐山一中2009届高三年级仿真训练考试(一)
理科综合能力测试
物理部分参考答案
题号
14
15
16
17
18
19
20
21
答案
B
C
AB
AC
AC
B
AC
AC
22.(1)(a)0.64 ,0.56 (6分)
(b)①③④ (3分)
(c)多次测量求μ的平均值或者多次实验选择一条点迹清晰的纸带进行测量(给出类似答案均得分) (3分)
 (2)(6分)
(2)(6分)
23.(14分)
 |
 (3分)
(3分)
 (3分)
(3分)
 (2分)
(2分)
(3分)
 |
|||
 |
|||
 |
|||
(3分)
(2分)
24.(18分)
解:(1)AD做简谐运动的平衡位置
 …………………………………(2分)
…………………………………(2分)
弹力最小时,对B受力分析可知,弹簧处于伸长状态
 ………………………………(2分)
………………………………(2分)
所以AD做简谐运动的振幅为
 …………………………(2分)
…………………………(2分)
(2)当A、D运动到最低点时,B对C的弹力最大,由简谐运动的对称性可知,弹簧的形变量为 (1分)
(1分)
对B受力分析知弹簧的最大弹力为
 ……………………(3分)
……………………(3分)
(3)A、D运动到最低点时弹簧的弹性势能最大,开始时A处于平衡状态,弹簧压缩量为
 …………………………………(2分)
…………………………………(2分)
对D有  ………………………(2分)
………………………(2分)
所以 
D与A碰撞过程由动量守恒定律,得
 ……………………………………(2分)
……………………………………(2分)
所以 
最大弹性势能
 ………………(2分)
………………(2分)
解得: ………………(1分)
………………(1分)
25.(22分)
解:(1)微粒在第一象限内做类平抛运动,得
 ………………………………(2分)
………………………………(2分)
解得 
水平位移 ………………………………(2分)
………………………………(2分)
解得 
竖直位移 …………………………………(2分)
…………………………………(2分)
解得 
由牛顿第二定律得  ………………………………(2分)
………………………………(2分)
解得 
(2) 对微粒由动能定理得
 …………………………(3分)
…………………………(3分)
解得  ………………………………………(1分)
………………………………………(1分)
由速度分解得  ………………………(2分)
………………………(2分)

(3)由计算可知微粒所受力有 ,所以微粒在第四象限做匀速圆周运动(2分)
,所以微粒在第四象限做匀速圆周运动(2分)
半径为  ………………………………(1分)
………………………………(1分)
由  得 ………………………(2分)
得 ………………………(2分)

微粒运动周期  ……………………(2分)
……………………(2分)
微粒运动时间  …………………………(1分)
…………………………(1分)
(14分)已知:通常状况下甲、乙、丙、丁为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③是工业制H的重要化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。请回答下列问题:

(1)反应④的化学方程式为 。
(2)B和E在一定条件下可发生反应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为 。
(3)在恒温恒压容器中加入一定量B,催化条件下发生反应B 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率
(填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率
(填“增大”、 “减小”或“不变”)。
(4)常温下,物质的量浓度相同的A、B、D三者的水溶液,由水电离出的c(OH-)大小顺序是(用A、B、D表示) 。
(5)惰性电极电解A和D的混合溶液,可生成丁单质和一种二元化合物M(与甲、乙所含元素相同),M为三角锥形分子,该反应的方程式为 。在碱性溶液中M与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物B和消毒剂ClO2气体,该反应的离子方程式为 。
(6)将Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是 mL。
查看习题详情和答案>>
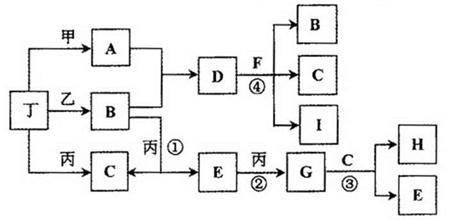
(14分)已知:通常状况下甲、乙、丙、丁为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③是工业制H的重要化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。请回答下列问题: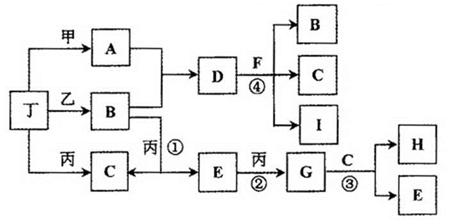
(1)反应④的化学方程式为 。
(2)B和E在一定条件下可发生反应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为 。
(3)在恒温恒压容器中加入一定量B,催化条件下发生反应B 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
(4)常温下,物质的量浓度相同的A、B、D三者的水溶液,由水电离出的c(OH-)大小顺序是(用A、B、D表示) 。
(5)惰性电极电解A和D的混合溶液,可生成丁单质和一种二元化合物M(与甲、乙所含元素相同),M为三角锥形分子,该反应的方程式为 。在碱性溶液中M与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物B和消毒剂ClO2气体,该反应的离子方程式为 。
(6)将Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是 mL。
(1)反应④的化学方程式为 。
(2)B和E在一定条件下可发生反应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为 。
(3)在恒温恒压容器中加入一定量B,催化条件下发生反应B
 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。(4)常温下,物质的量浓度相同的A、B、D三者的水溶液,由水电离出的c(OH-)大小顺序是(用A、B、D表示) 。
(5)惰性电极电解A和D的混合溶液,可生成丁单质和一种二元化合物M(与甲、乙所含元素相同),M为三角锥形分子,该反应的方程式为 。在碱性溶液中M与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物B和消毒剂ClO2气体,该反应的离子方程式为 。
(6)将Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是 mL。

按下列各要求填写
(1)写出结构简式:A


(2)写出所标反应的化学方程式:①
| 催化剂 |
| 加热、加压 |
| 催化剂 |
| 加热、加压 |
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
(3)写出下列序号发生的化学反应类型:②
(4)C、G、H中与等物质的量的乙炔燃烧消耗的氧气相同的化合物是(填字母)
(16分)(1)已知:还原性HSO3->I-,氧化性IO3->I2。在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应:NaIO3+NaHSO3→I2+Na2SO4+H2SO4+H2O
①配平上述反应的化学方程式(将化学计量数填在方框内);并写出其氧化产物____________。
②在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为____________ (填化学式);
(2)向某密闭容器中加人0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

①若t4时改变的条件为减小压强,则B的起始物质的量浓度为________mol/L;
②若t1=15 s,则t0~t1阶段以C浓度变化表示的平均反应速率为v(C)=_______mol/(L·s)。
③t3时改变的某一反应条件可能是_______(选填序号)。
a使用催化剂 b增大压强 c增大反应物浓度
④有甲、乙两个容积均为2L的密闭容器,在控制两容器温度相同且恒定情况下,向甲中通入3mol A,达到平衡时,B的体积分数为20%,则向乙容器中充入1 mol C和0.5mol B,达到平衡时,C的浓度c(C)=________
查看习题详情和答案>>