网址:http://m.1010jiajiao.com/timu_id_27372[举报]
1.D 2.C 3.D 4.B 5.B 6.D 7.C 8.C 9.D 10.B
11.B 12.D 13.D 14.C 15.B 16.D 17.A 18.B 19.D 20.B
21(共7分).(1)略 (1分)
极性 (1分) (2) H2O2 H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分)
H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分)
(3)H2O2+SO2=2H++SO42-(2分)
(4)ABC(1分)
22(共7分).(1)MgO 、C (1分) MgO(1分)
(2)小(1分), 在液态水中,几个水分子间存在氢键,在冰中,水分子大范围地以氢键相互 联结,形成相当疏松的晶体,使体积膨胀,密度减小。(1分)
(3) 4NH3+5O2=4NO+6H2O (1分) 2NH3 + 3CuO 3Cu + 3H2O + N2(2分)
3Cu + 3H2O + N2(2分)
23.(共9分)(1)①两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多(1分)
②约为53/42;(1分) ③不正确 (1分)
⑵ ①《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》(1分)
②托盘天平(1分)、温度计;(1分)
a吸热(1分) b:放热 (1分) c:NaHCO3溶解和NaHCO3与盐酸反应(1分)
24.(共14分)(1)Fe2O3 (1分) (2)D(1分)
(3)①氢氧化铁胶体,(1分)先产生红褐色沉淀,后沉淀逐渐溶解,溶液变成黄色且有气泡产生(1分)Fe3+ + 3SCN- == Fe(SCN)3 (1分)
Ba2+ + SO42- == BaSO4↓(1分)
②Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分)
③2Fe3+ + 3CO32- + 3H2O == 2Fe(OH)3↓+ 3CO2↑(2分)
④SO32-有较强的还原性,CO32-没有还原性(1分);SO32-水解能力较CO32-小(1分)
(4)4-21mO
 2mFe
(2分)
2mFe
(2分)
25.(共8分)(1)so2(1分)
(2)30(2分)
(3)CaC2+2H2O→Ca(OH)2+C2H2(2分)
(4)N2\CO\C2H4(各1分)
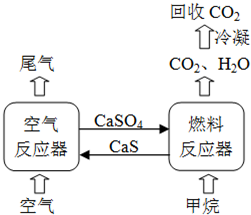 (2012?四川)直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙.硫酸钙可在有图所示的循环燃烧装置的燃料反应器重与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的.
(2012?四川)直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙.硫酸钙可在有图所示的循环燃烧装置的燃料反应器重与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的.请回答下列问题:
(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有
A.温室效应 B.酸雨 C.粉尘污染 D.水体富营养化
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的PH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙.
①二氧化碳与石灰石浆液反应得到的产物为
②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式:
(3)已知1molCH4在燃料反应器中完全反应生成气态水时吸热160.1kJ,1mol CH4在氧气中完全燃烧生成气态水时放热802.3kJ.写出空气反应器重发生反应的热化学方程式:
(4)回收的CO2与苯酚钠在一定条件下反应生成有机物M,其化学为C7H5O3Na,M经稀硫酸化得到一种药物中间N,N的结构简式为
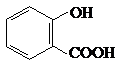 .
.①M的结构简式为


②分子中无-O-O-,醛基与苯环直接相连的N的同分异构体共有
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H= -802.3kJ/mol H2O(l)=H2O(g);△H= +44 kJ/mol,则4.8 g甲烷气体燃烧生成液态水放出热量为:_____________;
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:
CH4(g) +H2O(g)
 CO(g)+3H2(g);△H= +206.1 kJ/mol
CO(g)+3H2(g);△H= +206.1 kJ/mol ①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4) =3. 0mol/L,c(H2O)=8.5 mol/L,c(CO)= 2.0 mol/L,c(H2) =2.0 mol/L,则此时正逆反应的速率 关系是:__________(填序号)。
A. v正>v逆 B. v正<v逆 C.v正=v逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则 K1____(填“>”“<”或“=”)K2;
(3)利用MnFe2O4作催化剂,通过两步反应可将水分解制得H2,第一步反应为:
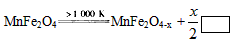 则框内的物质为:________; 第二步反应方程式为:
则框内的物质为:________; 第二步反应方程式为:______________________。
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
H2O(1)=H2O(g)△H=+44.0kJ?mol-1
则4.8g甲烷气体完全燃烧生成液态水,放出热量为
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g)
 CO(g)+3H2(g)△H=+206.1kJ?mol-1.
CO(g)+3H2(g)△H=+206.1kJ?mol-1.①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
| CH4 | H2O | CO | H2 |
| 3.0mol?L-1 | 8.5mol?L-1 | 2.0mol?L-1 | 2.0mol?L-1 |
A.v(正)>v(逆) B.v(正)<v(逆)C.v(正)=v(逆)D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,张山同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol?L-1 | H2O初始浓度/mol?L-1 | K |
| 1 | 360 | P | 2.00 | 6.80 | K1 |
| 2 | t | 101 | 2.00 | 6.80 | K2 |
| 3 | 360 | 101 | 2.00 | 6.80 | K3 |
设计实验2、3的目的是
实验l、2、3中反应的化学平衡常数的大小关系是
(3)利用催化剂,通过两步反应可将水分解制得氢气,若第一步反应为:MnFe2O4
| ||
| x |
| 2 |
第二步反应的化学方程式为
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
H2O(1)=H2O(g)△H=+44.0kJ?mol-1
则4.8g甲烷气体完全燃烧生成液态水,放出热量为______.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g)
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
| CH4 | H2O | CO | H2 |
| 3.0mol?L-1 | 8.5mol?L-1 | 2.0mol?L-1 | 2.0mol?L-1 |
A.v(正)>v(逆) B.v(正)<v(逆)C.v(正)=v(逆)D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,张山同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol?L-1 | H2O初始浓度/mol?L-1 | K |
| 1 | 360 | P | 2.00 | 6.80 | K1 |
| 2 | t | 101 | 2.00 | 6.80 | K2 |
| 3 | 360 | 101 | 2.00 | 6.80 | K3 |
设计实验2、3的目的是______;
实验l、2、3中反应的化学平衡常数的大小关系是______(用K1、K2、K3表示).
(3)利用催化剂,通过两步反应可将水分解制得氢气,若第一步反应为:MnFe2O4
 MnFe2O4-x+
MnFe2O4-x+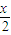 □↑,则框内物质为______;
□↑,则框内物质为______;第二步反应的化学方程式为______(可不写反应条件).
查看习题详情和答案>>
(9分)随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:
CH4(g)+2O2(g)= CO2(g)+2H2O(g);△H= —802.3kJ·mol-1
H2O(1) =H2O(g),△H =+44.0kJ·mol-l
则4.8g甲烷气体完全按燃烧生成液态水,放出热量为 。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。
该反应为CH4(g)+H2O(g) CO(g)+3H2(g);△H=+206.lkJ·mol-l。
CO(g)+3H2(g);△H=+206.lkJ·mol-l。
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
则此时正、逆反应速率的关系是 。(填标号)
| A.v(正)>v(逆) | B.v(正)<v(逆) |
| C.v(正)=v(逆) | D.无法判断 |
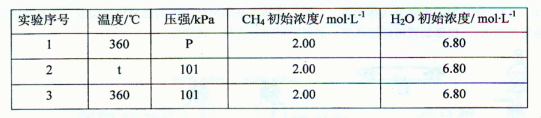
表中t= ,P= ;
设计实验2、3的目的是
实验l、2、3中反应的化学平衡常数的大小关系是 (用K1、K2、K3表示)。 查看习题详情和答案>>