网址:http://m.1010jiajiao.com/timu_id_27368[举报]
1.D 2.C 3.D 4.B 5.B 6.D 7.C 8.C 9.D 10.B
11.B 12.D 13.D 14.C 15.B 16.D 17.A 18.B 19.D 20.B
21(共7分).(1)略 (1分)
极性 (1分) (2) H2O2 H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分)
H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分)
(3)H2O2+SO2=2H++SO42-(2分)
(4)ABC(1分)
22(共7分).(1)MgO 、C (1分) MgO(1分)
(2)小(1分), 在液态水中,几个水分子间存在氢键,在冰中,水分子大范围地以氢键相互 联结,形成相当疏松的晶体,使体积膨胀,密度减小。(1分)
(3) 4NH3+5O2=4NO+6H2O (1分) 2NH3 + 3CuO 3Cu + 3H2O + N2(2分)
3Cu + 3H2O + N2(2分)
23.(共9分)(1)①两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多(1分)
②约为53/42;(1分) ③不正确 (1分)
⑵ ①《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》(1分)
②托盘天平(1分)、温度计;(1分)
a吸热(1分) b:放热 (1分) c:NaHCO3溶解和NaHCO3与盐酸反应(1分)
24.(共14分)(1)Fe2O3 (1分) (2)D(1分)
(3)①氢氧化铁胶体,(1分)先产生红褐色沉淀,后沉淀逐渐溶解,溶液变成黄色且有气泡产生(1分)Fe3+ + 3SCN- == Fe(SCN)3 (1分)
Ba2+ + SO42- == BaSO4↓(1分)
②Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分)
③2Fe3+ + 3CO32- + 3H2O == 2Fe(OH)3↓+ 3CO2↑(2分)
④SO32-有较强的还原性,CO32-没有还原性(1分);SO32-水解能力较CO32-小(1分)
(4)4-21mO
 2mFe
(2分)
2mFe
(2分)
25.(共8分)(1)so2(1分)
(2)30(2分)
(3)CaC2+2H2O→Ca(OH)2+C2H2(2分)
(4)N2\CO\C2H4(各1分)
(1)混合气体中NO2和NO体积比为______;
(2)所用HNO3的物质的量浓度为______mol/L;
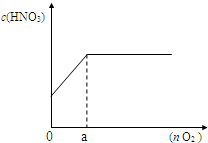
(3)如图,若将上述反应产生的混合气体加入n mol氧气一起通入水中,配成100mL溶液,所得硝酸溶液的物质的量浓度(c)与加入氧气的物质的量(n)的关系.
①a 点的数值是______mol;
②当n=0.12mol时,所得硝酸溶液的物质的量浓度______;
③通过计算,求出所得硝酸溶液的物质的量浓度(c)与加入氧气的物质的量(n)的关系式______,______.(写出计算过程)
(1)混合气体中NO2和NO体积比为______;
(2)所用HNO3的物质的量浓度为______mol/L;
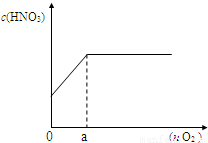
(3)如图,若将上述反应产生的混合气体加入n mol氧气一起通入水中,配成100mL溶液,所得硝酸溶液的物质的量浓度(c)与加入氧气的物质的量(n)的关系.
①a 点的数值是______mol;
②当n=0.12mol时,所得硝酸溶液的物质的量浓度______;
③通过计算,求出所得硝酸溶液的物质的量浓度(c)与加入氧气的物质的量(n)的关系式______,______.(写出计算过程)
 查看习题详情和答案>>
查看习题详情和答案>>
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
⑴工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程
式是: 。
不采用铜跟浓硫酸反应来制取硫酸铜的原因是
。
⑵在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
⑶若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
⑷将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为 。
查看习题详情和答案>>