��Ŀ����
��500mL ijŨ�ȵ�������Һ�м���20g���ۣ���ַ�Ӧ����ӦҺ���ˡ�ϴ�ӡ�����Ƶù�������Ϊ3.2g��������NO2��NO���徭�ⶨΪ8.96L����״��������1�����������NO2��NO�����Ϊ______��
��2������HNO3�����ʵ���Ũ��Ϊ______mol/L��
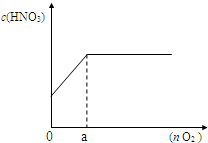
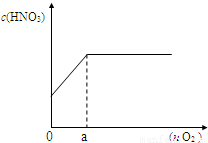
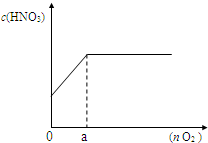
��3����ͼ������������Ӧ�����Ļ���������n mol����һ��ͨ��ˮ�У����100mL��Һ������������Һ�����ʵ���Ũ�ȣ�c����������������ʵ�����n���Ĺ�ϵ��
��a �����ֵ��______mol��
�ڵ�n=0.12molʱ������������Һ�����ʵ���Ũ��______��
��ͨ�����㣬�������������Һ�����ʵ���Ũ�ȣ�c����������������ʵ�����n���Ĺ�ϵʽ______��______����д��������̣�
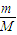 ����μӷ�Ӧ��Fe�����ʵ���������n=
����μӷ�Ӧ��Fe�����ʵ���������n=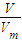 ��������������ʵ�������ʣ�࣬������ȫ��Ӧ����Ӧ����������������NO2��NO�����ʵ����ֱ�Ϊxmol��ymol�����ݵ���ת���غ���������ʵ���֮���з��̣��ݴ˼�����
��������������ʵ�������ʣ�࣬������ȫ��Ӧ����Ӧ����������������NO2��NO�����ʵ����ֱ�Ϊxmol��ymol�����ݵ���ת���غ���������ʵ���֮���з��̣��ݴ˼�������2������NԪ���غ��֪n��HNO3��=2n[Fe��NO3��2]+n��NO+NO2�����ݴ˼��㣻
��3����a��NO2��NO������ȫ��Ӧ�����ݵ���ע���غ㣬������õĵ��ӵ��ڲμӷ�Ӧ�����ṩ�ĵ��ӣ��ݴ˼������������ʵ�����
�ڸ��ݢ���a��ֵ���жϷ����ķ�Ӧ����0.12��a�������NԪ���غ���㣬���ɵ����
��0.12��a�����ݻ��������NO2��NO���������ϵ��д�����������������Ӧ���ܷ�Ӧ����ʽ������������������ˮ��Ӧ�����������������ɵ����ᡢʣ���NO2��NO�����������ʵ������ټ������������ˮ��Ӧ���ɵ���������ʵ������ٸ���c=
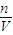 ��������Ũ�ȣ�
��������Ũ�ȣ��۸��ݻ��������NO2��NO���������ϵ��д�����������������Ӧ���ܷ�Ӧ����ʽ���ݴ����ۣ�
A����n��O2����0.15molʱ��NO2��NO��ȫ��Ӧ������NԪ�ؼ��������������ʵ������ٸ���c=
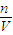 ��������Ũ�ȣ�
��������Ũ�ȣ�B����0��n��O2����0.15molʱ������������������������������ˮ��Ӧ�����������������ɵ����ᡢʣ���NO2��NO�����������ʵ������ټ������������ˮ��Ӧ���ɵ���������ʵ������ٸ���c=
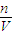 ��������Ũ�ȣ�
��������Ũ�ȣ�����⣺��1����Ϊ������ʣ�࣬������Һ�д��ڵ�һ����Fe��NO3��2���μӷ�Ӧ��n��Fe��=
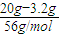 =0.3mol��
=0.3mol��n��NO+NO2��=
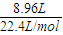 =0.4mol��
=0.4mol����NO2��NO�����ʵ����ֱ�Ϊxmol��ymol����
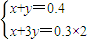 �����x=0.3��y=0.1��
�����x=0.3��y=0.1���ʻ��������NO2��NO�����Ϊ0.3mol��0.1mol=3��1
�ʴ�Ϊ��3��1��
��2����Ϊ������ʣ�࣬������Һ�д��ڵ�һ����Fe��NO3��2���ɣ�1���вμӷ�Ӧ��n��Fe��=0.3mol����n[Fe��NO3��2]=0.3mol��n��NO+NO2��=0.4mol������NԪ���غ㣺n��HNO3��=2n[Fe��NO3��2]+n��NO+NO2��=0.3mol×2+0.4mol=1mol��
�ʣ�c��HNO3��=
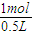 =2mol/L��
=2mol/L���ʴ�Ϊ��2��
��3������ͼ��֪��a��NO2��NO������ȫ��Ӧ�����ݵ���ע���غ㣬������õĵ��ӵ��ڲμӷ�Ӧ�����ṩ�ĵ��ӣ��ɣ�1���п�֪�μӷ�Ӧ��n��Fe��=0.3mol����Ӧ����Fe��NO3��2����a�����������ʵ���Ϊ
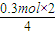 =0.15mol��
=0.15mol���ʴ�Ϊ��0.15��
���ɣ�1����֪���������NO2��NO�����Ϊ3��1����������һ��ͨ��ˮ�У��ܷ�ӦʽΪ6NO2+2NO+3O2+4H2O=8HNO3��
����0.12��a�����������㣬���ܷ�Ӧ����ʽ��֪��������ȫ��Ӧ��������Ϊ0.12mol×
 =0.32mol������NO2Ϊ0.12mol×
=0.32mol������NO2Ϊ0.12mol× =0.24mol����ʣ��NO2Ϊ0.3mol-0.24mol=0.06mol���ʷ�����Ӧ3NO2+H2O=2HNO3+NO������������Ϊ0.06mol×
=0.24mol����ʣ��NO2Ϊ0.3mol-0.24mol=0.06mol���ʷ�����Ӧ3NO2+H2O=2HNO3+NO������������Ϊ0.06mol× =0.04mol���ʹ���������0.32mol+0.04mol=0.36mol�����������Ũ��Ϊ��
=0.04mol���ʹ���������0.32mol+0.04mol=0.36mol�����������Ũ��Ϊ��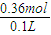 =3.6mol/L��
=3.6mol/L���ʴ�Ϊ��3.6mol/L��
��A����n��O2����0.15molʱ������������NO2��NO��ȫ��Ӧ��NԪ�ؿ�֪�����������ʵ���n��HNO3��=+n��NO+NO2��=0.4mol����c��HNO3��=
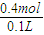 =4mol/L��
=4mol/L��B����0��n��O2����0.15molʱ����������������6NO2+2NO+3O2+4H2O=8HNO3��֪��������ȫ��Ӧ��������Ϊnmol×
 =
=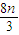 mol������NO2Ϊnmol×
mol������NO2Ϊnmol× =2nmol����ʣ��NO2Ϊ0.3mol-2n mol=��0.3-2n��mol���ʷ�����Ӧ3NO2+H2O=2HNO3+NO������������Ϊ��0.3-2n��mol×
=2nmol����ʣ��NO2Ϊ0.3mol-2n mol=��0.3-2n��mol���ʷ�����Ӧ3NO2+H2O=2HNO3+NO������������Ϊ��0.3-2n��mol× =��0.2-
=��0.2-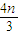 ��mol���ʹ���������
��mol���ʹ���������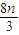 mol+��0.2-
mol+��0.2-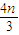 ��mol=��0.2+
��mol=��0.2+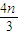 ��mol����c��HNO3��=
��mol����c��HNO3��=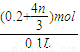 =��2+
=��2+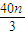 ��mol/L��
��mol/L���ʴ�Ϊ��n��0.15mol��c��HNO3��=4mol/L��0��n��0.15mol��c��HNO3��=��2+
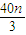 ��mol/L��
��mol/L�����������⿼������ļ��㡢���ݷ���ʽ�ļ���ȣ���Ŀ�������ϴ��̸��ӣ�Ϊ�״���Ŀ���ѶȽϴ�ע�������غ�˼����еļ��㣬��3���йؼ��������ܷ�Ӧʽ�������ۣ����㣮

ij����С����MnO2��Ũ�����Ʊ�Cl2ʱ�����ø����չ�����SO2��NaOH��Һ����β���������մ�����
��1�������SO2�����NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ________________��
��2����ӦCl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O�еĻ�ԭ��Ϊ_________��
��3�������MnO2��Ũ�����Ʊ�Cl2�����ӷ���ʽ�� _______ _________��
��4�����14.2g������������������Ӧ��Ȼ�����ɵ�������500mLijŨ�ȵ�NaOH��Һǡ�÷�Ӧ�����NaOH��Ũ��Ϊ ����д��������̣�
��5������β��һ��ʱ�������Һ��ǿ���ԣ��п϶�����Cl![]() ��OH
��OH![]() ��SO
��SO![]() �������ʵ�飬̽��������Һ�п��ܴ��ڵ����������ӣ������ǿ�����CO2��Ӱ�죩��
�������ʵ�飬̽��������Һ�п��ܴ��ڵ����������ӣ������ǿ�����CO2��Ӱ�죩��
������������� ��
����1��ֻ����SO32-������2���Ȳ�����SO32-Ҳ������ClO![]() ������3��SO32-��ClO
������3��SO32-��ClO![]() �����ڡ�
�����ڡ�
���ʵ�鷽��������ʵ�顣���ڴ����д����ʵ�鲽����Ӧ��Ԥ������ͽ��ۡ���ѡʵ���Լ���3moL![]() L-1H2SO4��1moL
L-1H2SO4��1moL![]() L-1NaOH��0.01mol
L-1NaOH��0.01mol![]() L-1KMnO4������-KI��Һ����ɫʯ����Һ��
L-1KMnO4������-KI��Һ����ɫʯ����Һ��
| ʵ�鲽�� | Ԥ������ͽ��� |
|
| |
| ����2����A�Թ��еμ���ɫʯ����Һ | |
| ����3����B�Թ��еμ�0.01mol |
ij����С����MnO2��Ũ�����Ʊ�Cl2ʱ�����ø����չ�����SO2��NaOH��Һ����β���������մ�����
��1�������SO2�����NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ________________��
��2����ӦCl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O�еĻ�ԭ��Ϊ_________��
��3�������MnO2��Ũ�����Ʊ�Cl2�����ӷ���ʽ�� _______ _________��
��4�����14.2g������������������Ӧ��Ȼ�����ɵ�������500mLijŨ�ȵ�NaOH��Һǡ�÷�Ӧ�����NaOH��Ũ��Ϊ ����д��������̣�
��5������β��һ��ʱ�������Һ��ǿ���ԣ��п϶�����Cl![]() ��OH
��OH![]() ��SO
��SO �������ʵ�飬̽��������Һ�п��ܴ��ڵ����������ӣ������ǿ�����CO2��Ӱ�죩��
�������ʵ�飬̽��������Һ�п��ܴ��ڵ����������ӣ������ǿ�����CO2��Ӱ�죩��
������������� ��
����1��ֻ����SO32-������2���Ȳ�����SO32-Ҳ������ClO ������3��SO32-��ClO
������3��SO32-��ClO![]() �����ڡ�
�����ڡ�
���ʵ�鷽��������ʵ�顣���ڴ����д����ʵ�鲽����Ӧ��Ԥ������ͽ��ۡ���ѡʵ���Լ���3moL L-1H2SO4��1moL
L-1H2SO4��1moL L-1NaOH��0.01mol
L-1NaOH��0.01mol![]() L-1KMnO4������-KI��Һ����ɫʯ����Һ��
L-1KMnO4������-KI��Һ����ɫʯ����Һ��
| ʵ�鲽�� | Ԥ������ͽ��� |
|
|
|
| ����2����A�Թ��еμ���ɫʯ����Һ |
|
| ����3����B�Թ��еμ�0.01mol |
|
 ��2011?������һģ����500mL ijŨ�ȵ�������Һ�м���20g���ۣ���ַ�Ӧ����ӦҺ���ˡ�ϴ�ӡ�����Ƶù�������Ϊ3.2g��������NO2��NO���徭�ⶨΪ8.96L����״������
��2011?������һģ����500mL ijŨ�ȵ�������Һ�м���20g���ۣ���ַ�Ӧ����ӦҺ���ˡ�ϴ�ӡ�����Ƶù�������Ϊ3.2g��������NO2��NO���徭�ⶨΪ8.96L����״������ ����1��ȡ��������Һ���Թ��У��μ�3 moL
����1��ȡ��������Һ���Թ��У��μ�3 moL ����1��ȡ��������Һ���Թ��У��μ�3 moL
����1��ȡ��������Һ���Թ��У��μ�3 moL