摘要:3.下列各组物质的分类正确的是 A.强碱:NaOH.CsOH.Ba(OH)2 B.非电解质:C12.NH3.C2H5OH C.非极性分子:C60.CO2.CH2C12
网址:http://m.1010jiajiao.com/timu_id_26661[举报]
题号
1
2
3
4
5
6
7
8
答案
C
A
A
B
C
D
B
B
题号
9
10
11
12
13
14
15
答案
C
D
B
B
B
C
D
16.(8分,每空两分)
H O
| ||
(1)HOCH2CH2―N―C―CH3
(2)②
NH2 O
| ||
(3)①CH3CH2CH―C―OH
NO2 NO2
| |
②CH3CH―CH2CH2CH3 CH3CH―CH(CH3)2

 (2)氟(1分);
(2)氟(1分); 


 ③4FeS2+11O2 2Fe2O3+8SO2(2分)
③4FeS2+11O2 2Fe2O3+8SO2(2分) 20.(共6分,每空2分)
20.(共6分,每空2分) (1)NH+4+OH NH3?H2O NH3↑+H2O
(1)NH+4+OH NH3?H2O NH3↑+H2O

 H2CO3+OH-
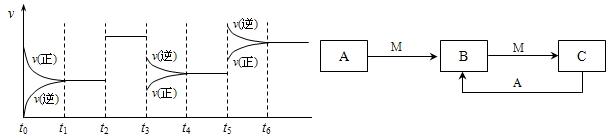
H2CO3+OH- 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______.
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______. 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 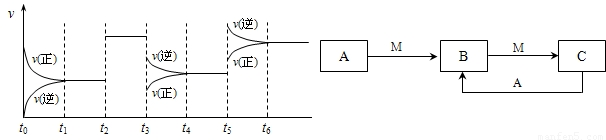
 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______.
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______. 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.  CO2(g) +H2(g) △H=-42KJ/mol
CO2(g) +H2(g) △H=-42KJ/mol 