题目内容
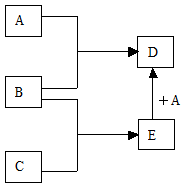
A、B、C均为常见的物质,且有如下转化关系: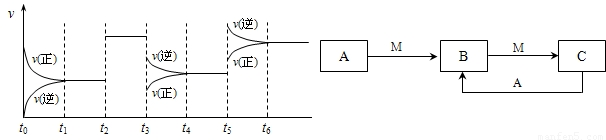
(1)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子.
①请用离子方程式表示C溶液呈现酸碱性的原因:______.
②用石墨电极电解B的饱和溶液时,观察到的现象是______,
阳极反应式为______,电解一段时间后,溶液的pH______(填“增大”、“减小”或“不变”).
(2)若A、B、C均为含硫元素的物质,则A分子中的化学键类型是______.
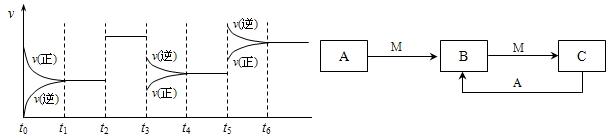
①若C在一定条件下可发生如下的反应:2SO2+O2
 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______.
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______.A t2时加入了催化剂 B t3时降低了温度
C t5时增大了压强 D t4~t5时间内反应物的转化率最低
②一定温度下的密闭容器内,充入4mol SO2、2mol O2 发生反应2SO2+O2
 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 等温等容时再充入2mol SO2、1mol O2,达到平衡时若SO3的体积分数为b%,SO2的转化率为n,则a______b,m______n(填“>”、“=”或“<”,下同).若改为等温等压,则a______b,m______n.
【答案】分析:(1)A、B、C均为常见的物质,若M是第IVA族某元素的最高价氧化物,且M为气体,则为CO2,组成A的阴阳离子均含有10个电子,则A为NaOH;结合转化过程可知,A为NaOH,B为Na2CO3;C为NaHCO3;①依据碳酸氢钠溶液中碳酸氢根离子水解呈碱性;②电解饱和碳酸钠溶液实质是电解水,过程中有碳酸钠晶体析出,根据电解过程溶液浓度变化分析判断;
(2)若A、B、C均为含硫元素的物质,A+M→B;B+M→C;C+A→B,推断为A为H2S,B为S,C为SO2,M为O2;所以A中含极性共价键;
①依据图象变化,结合化学平衡的影响因素分析判断;
②等温等容时再充入2mol SO2、1mol O2,相当于增大了容器中的压强,平衡右移;若若改为等温等压,依据等比等效可知,平衡不动.
解答:解:(1)若M是第IVA族某元素的最高价氧化物,且M为气体,则为CO2,组成A的阴阳离子均含有10个电子,则A为NaOH;结合转化过程可知,A为NaOH,B为Na2CO3;C为NaHCO3;
①C溶液为碳酸氢钠溶液,溶液中碳酸氢根离子水解呈碱性,离子方程式为:HCO3-+H2O H2CO3+OH-;故答案为:HCO3-+H2O
H2CO3+OH-;故答案为:HCO3-+H2O H2CO3+OH-;
H2CO3+OH-;
②电解饱和碳酸钠溶液实质是电解水,阴阳两极均有气体放出,阳极电极反应为:4OH--4e-=O2↑+2H2O,阴极电极反应为:4H++4e-=2H2↑,一定温度下碳酸钠溶解度不变,所以溶液变浑浊或有晶体析出;但饱和溶液的浓度不变,PH不变;故答案为:阴阳两极均有气体放出,溶液变浑浊或有晶体析出;4OH--4e-=O2↑+2H2O;不变;
(2)若A、B、C均为含硫元素的物质,A+M→B;B+M→C;C+A→B,推断为A为H2S,B为S,C为SO2,M为O2;所以A中含极性共价键,故答案为:极性共价键;
①C的化学反应是化学平衡:2SO2+O2 2SO3 △H<0,结合图象和影响化学平衡的因素分析;
2SO3 △H<0,结合图象和影响化学平衡的因素分析;
A、t2时加入了催化剂,催化剂不改变化学平衡,能加快化学反应速率,故A正确;
B、若t3时降低了温度,应正逆反应速率都减小,故B错误;
C、t5时增大了压强正逆反应速率都增大,增大压强平衡正向进行,正反应速率大于逆反应速率,故C错误;
D、t4~t5时间内是降温,反应正向是放热反应,所以平衡正向进行,反应物的转化率比开始增大,故D错误;
故选A.
②等温等容时再充入2mol SO2、1mol O2,相当于加入了相同的平衡体系,压强增大平衡正向进行,所以达到平衡时若SO3的体积分数为b%>a%,SO2的转化率为n>m;若改为等温等压,维持恒压条件,最终达到的平衡和原平衡相同,所以平衡时SO3的体积分数和SO2的转化率与原平衡相同,故答案为:<;<.
点评:本题考查了无机化合物的转化和性质应用,结合物质的性质主要考查了盐类水解的应用,电解原理的应用和溶液性质的判断,化学平衡的影响因素结合图象分析对平衡的影响判断,恒温恒容、恒温恒压条件下的化学平衡移动的方向判断,题目较综合,熟悉基本知识是解题关键.
(2)若A、B、C均为含硫元素的物质,A+M→B;B+M→C;C+A→B,推断为A为H2S,B为S,C为SO2,M为O2;所以A中含极性共价键;
①依据图象变化,结合化学平衡的影响因素分析判断;
②等温等容时再充入2mol SO2、1mol O2,相当于增大了容器中的压强,平衡右移;若若改为等温等压,依据等比等效可知,平衡不动.
解答:解:(1)若M是第IVA族某元素的最高价氧化物,且M为气体,则为CO2,组成A的阴阳离子均含有10个电子,则A为NaOH;结合转化过程可知,A为NaOH,B为Na2CO3;C为NaHCO3;
①C溶液为碳酸氢钠溶液,溶液中碳酸氢根离子水解呈碱性,离子方程式为:HCO3-+H2O
 H2CO3+OH-;故答案为:HCO3-+H2O
H2CO3+OH-;故答案为:HCO3-+H2O H2CO3+OH-;
H2CO3+OH-;②电解饱和碳酸钠溶液实质是电解水,阴阳两极均有气体放出,阳极电极反应为:4OH--4e-=O2↑+2H2O,阴极电极反应为:4H++4e-=2H2↑,一定温度下碳酸钠溶解度不变,所以溶液变浑浊或有晶体析出;但饱和溶液的浓度不变,PH不变;故答案为:阴阳两极均有气体放出,溶液变浑浊或有晶体析出;4OH--4e-=O2↑+2H2O;不变;
(2)若A、B、C均为含硫元素的物质,A+M→B;B+M→C;C+A→B,推断为A为H2S,B为S,C为SO2,M为O2;所以A中含极性共价键,故答案为:极性共价键;
①C的化学反应是化学平衡:2SO2+O2
 2SO3 △H<0,结合图象和影响化学平衡的因素分析;
2SO3 △H<0,结合图象和影响化学平衡的因素分析;A、t2时加入了催化剂,催化剂不改变化学平衡,能加快化学反应速率,故A正确;
B、若t3时降低了温度,应正逆反应速率都减小,故B错误;
C、t5时增大了压强正逆反应速率都增大,增大压强平衡正向进行,正反应速率大于逆反应速率,故C错误;
D、t4~t5时间内是降温,反应正向是放热反应,所以平衡正向进行,反应物的转化率比开始增大,故D错误;
故选A.
②等温等容时再充入2mol SO2、1mol O2,相当于加入了相同的平衡体系,压强增大平衡正向进行,所以达到平衡时若SO3的体积分数为b%>a%,SO2的转化率为n>m;若改为等温等压,维持恒压条件,最终达到的平衡和原平衡相同,所以平衡时SO3的体积分数和SO2的转化率与原平衡相同,故答案为:<;<.
点评:本题考查了无机化合物的转化和性质应用,结合物质的性质主要考查了盐类水解的应用,电解原理的应用和溶液性质的判断,化学平衡的影响因素结合图象分析对平衡的影响判断,恒温恒容、恒温恒压条件下的化学平衡移动的方向判断,题目较综合,熟悉基本知识是解题关键.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
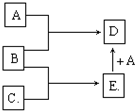 已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)
已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)
 H2CO3+OH-
H2CO3+OH- 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是