网址:http://m.1010jiajiao.com/timu_id_258376[举报]
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
题 号
1
2
3
4
5
6
7
8
9
10
答 案
D
A
D
C
B
B
C
C
A
A
题 号
11
12
13
14
15
16
17
18
19
20
答 案
C
A
A
D
C
D
A
C
D
D
二、实验题: (本大题包括2小题,共18分)
21、(1)铁屑溶解,溶液逐渐变为浅绿色,有大量无色气泡产生(2分)
杂质Cu与Fe形成原电池,化学反应速率加快(2分)
(2)2FeC12+2HC1+H2O2=2FeC13+2H2O(2分)
(3)在HCl气氛中加热浓缩,冷却结晶,过滤(2分)
FeC13+3H2O Fe(OH)3 + 3HCl;直接加热时,FeC13水解会产生Fe(OH)3
(2分)
Fe(OH)3 + 3HCl;直接加热时,FeC13水解会产生Fe(OH)3
(2分)
(4)B(2分)
22、(1)A(2分) (2)2H++ 2e-= H2↑ (2分)
(3)2Fe3++ Fe = 3Fe2+ (2分)
三、填空题:(本大题共4小题。共36分)
23、(1)⑤⑥(2分) ①④⑧(2分)
(2)2Fe3++3CaCO3+3H2O = 2Fe(OH)3+3Ca2++3CO2↑ (2分)
或;2Fe3++3H2O Fe(OH)3+3H+ CaCO3+2H+ =
Ca2++H2O+3CO2↑
Fe(OH)3+3H+ CaCO3+2H+ =
Ca2++H2O+3CO2↑
(3)HCO3-+A1O2-+H2O=Al(OH)3↓+CO32-(2分)
24、(1)B(2分) ;
(2)CH3COONH4溶液呈中性,滴入Mg(OH)2 悬浊液,若Mg(OH)2溶解,则说明乙同学解释正确,若Mg(OH)2不溶,则甲同学解释正确。(2分)
(3)乙(2分);Mg(OH)2 + 2NH4+ ㄔ Mg2+ + 2NH3?H2O(2分)
25、(1)A、D(2分)
(2)用湿润的红色石蕊试纸放在管口处,若试纸变蓝说明有氨气生成。(2分)
(3)该反应是可逆反应,10mol N2与30mol H2不能完成反应,所以放出的热量小于924kJ。(2分)
(4)N2+6H++6e-=2NH3(2分)
26、(1)0.05(2分), 25 (2分)
(2) H2SO4与(NH4)2SO4(2分), (NH4)2SO4与NH3?H2O(2分)(本小题若其它合理答案也给分)
(3)=7 (2分) (4)BC (2分)
四、计算题:(本大题共6分)27、AgI(2分)、AgCl(2分)、4.1×10-14mol/L(2分)
附加题:
28、(1)BiCl3+H2O=BiOCl↓+2HCl(2分)
(2)不合理 (2分) 因BiOCl中Cl呈-1价而非+1(2分)
(3)将BiCl3溶于含适量HCl的蒸馏水中(2分)
(4)BiOCl+H2O BiOCl+2H++2Cl-,[Cl-]增大时,抑制了BiCl3水解(2分)
BiOCl+2H++2Cl-,[Cl-]增大时,抑制了BiCl3水解(2分)
29、(1) 正反应 (2分) 7.0 (2分)
(2) 不相等(2分) 因为这两种情况是在两个不同温度下达到化学平衡的(2分),平衡状态不同,所以物质的量也不同(2分)。
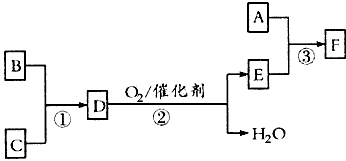
(1)常温下向D的水溶液中逐滴加入稀盐酸至pH =7,用一个等式表示所得溶液中所有离子浓度之间的关系:______________
(2)取0.3mol B和0.1 mol C放入容积为1L的密闭容器中,在一定条件下反应,达到平衡后得到0. 12 mol D,此时缩小容器容积为0.5 L,n(D)将____(填“增大”“减 小”或“不变”,下同),反应的平衡常数
_________。
(3)工业上电解饱和食盐水制取A时,A在________极生成。实验室制取A的化学反应方程式为:__________________。
(4)已知反应③中参加反应的A、E物质的量之比为1:2,则F的化学式为:__________。
(1)铝元素在周期表中处于____________(填周期数、主族数);Al3+的结构示意图为____________。
(2)无机富锌涂料在防止钢铁腐蚀的过程中,锌电极上的电极反应为,掺入少量铝粉的无机富锌涂料能使钢铁抗腐蚀能力增强的可能原因之一是________________________。
(3)铝热反应在冶炼金属及定向爆破等实际应用中有着重要的用途。铝和氧化铁在高温条件下反应,当转移3 mol电子时,产生铁的质量是____________g。
(4)铝铵矾[NH4Al(SO4)2·12H2O]是一种重要的复盐,当向铝铵矾稀溶液中逐滴加入0.1 mol·L-1NaOH溶液出现了如下a、b、c三个阶段的图象
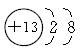
根据上图完成下列离子反应方程式:
b阶段:________________________________________________;
c阶段:________________________________________________。
查看习题详情和答案>>(10分)某校化学兴趣小组的同学在实验室配制0.10mol/L的NaOH溶液1 000mL,用于测定某稀硫酸的浓度。请回答下列问题:
⑴配制0.10mol/L的NaOH溶液1 000mL时,用到的玻璃仪器有烧杯、胶头滴管、 。
⑵配制过程中,若用于定容的容器中含有少量蒸馏水,则配制得到的溶液浓度 (填“偏小”、“偏大”或“不变”)。
⑶向18.00mL待测稀硫酸中逐滴加入配制所得溶液,至21.60mL时,正好完全反应。
①取用18.00mL待测稀硫酸时,能否使用量筒,并说明你的理由 。
②判断稀硫酸和NaOH溶液正好完全反应的方法和现象是 。
③待测稀硫酸中H+的浓度为 。 查看习题详情和答案>>水溶性无机富锌涂料对防止钢铁腐蚀具有重要作用,研究表明无机富锌涂料中掺入少量铝粉可延长钢铁的抗腐蚀年限。请回答下列问题。
(1)铝元素在周期表中处于 (填周期数、主族数);Al3+的结构示意图为 。
(2)无机富锌涂料在防止钢铁腐蚀的过程中,锌电极上的电极反应为 ,掺入少量铝粉的无机富锌涂料能使钢铁抗腐蚀能力增强的可能原因之一是
。
(3)铝热反应在冶炼金属及定向爆破等实际应用中有着重要的用途。铝和氧化铁在高温条件下反应,当转移3mol电子时,产生铁的质量是 g。
(4)铝铵矾[NH4Al(SO4)2?12H2O]是一种重要的复盐,当向铝铵矾稀溶液中逐滴加入0.1mol?L-1 NaOH溶液出现了如下a、b、c三个阶段的图象
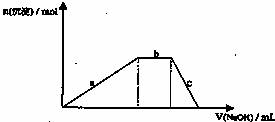
根据上图完成下列离子反应方程式:
b阶段: ;
c阶段: 。
查看习题详情和答案>>(10分)某校化学兴趣小组的同学在实验室配制0.10mol/L的NaOH溶液1 000mL,用于测定某稀硫酸的浓度。请回答下列问题:
⑴配制0.10mol/L的NaOH溶液1 000mL时,用到的玻璃仪器有烧杯、胶头滴管、 ▲ 。
⑵配制过程中,若用于定容的容器中含有少量蒸馏水,则配制得到的溶液浓度 ▲ (填“偏小”、“偏大”或“不变”)。
⑶向18.00mL待测稀硫酸中逐滴加入配制所得溶液,至21.60mL时,正好完全反应。
①取用18.00mL待测稀硫酸时,能否使用量筒,并说明你的理由 ▲ 。
②判断稀硫酸和NaOH溶液正好完全反应的方法和现象是 ▲ 。
③待测稀硫酸中H+的浓度为 ▲ 。
查看习题详情和答案>>