题目内容
水溶性无机富锌涂料对防止钢铁腐蚀具有重要的作用。研究表明在无机富锌涂料中掺入少量铝粉可延长钢铁的抗腐蚀年限。请回答下列问题。(1)铝元素在周期表中处于____________(填周期数、主族数);Al3+的结构示意图为____________。
(2)无机富锌涂料在防止钢铁腐蚀的过程中,锌电极上的电极反应为,掺入少量铝粉的无机富锌涂料能使钢铁抗腐蚀能力增强的可能原因之一是________________________。
(3)铝热反应在冶炼金属及定向爆破等实际应用中有着重要的用途。铝和氧化铁在高温条件下反应,当转移3 mol电子时,产生铁的质量是____________g。
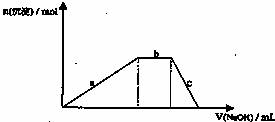
(4)铝铵矾[NH4Al(SO4)2·12H2O]是一种重要的复盐,当向铝铵矾稀溶液中逐滴加入0.1 mol·L-1NaOH溶液出现了如下a、b、c三个阶段的图象
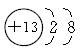
根据上图完成下列离子反应方程式:
b阶段:________________________________________________;
c阶段:________________________________________________。
(1)第三周期、ⅢA族;
(2)Zn-2e-![]() Zn2+ 可能的原因:①相同质量的铝、锌相比,铝失电子数目比锌多;②铝的活泼性比锌强,发生电化学腐蚀时铝先失去电子,对钢铁产生了双层保护作用;③铝可形成致密的氧化膜使钢铁表面涂层更加牢固。(其他合理答案均可)
Zn2+ 可能的原因:①相同质量的铝、锌相比,铝失电子数目比锌多;②铝的活泼性比锌强,发生电化学腐蚀时铝先失去电子,对钢铁产生了双层保护作用;③铝可形成致密的氧化膜使钢铁表面涂层更加牢固。(其他合理答案均可)
(3)
(4)![]() +OH-
+OH-![]() NH3·H2O
NH3·H2O
Al(OH)3+OH![]()
![]() +2H2O
+2H2O
解析:(2)在防止钢铁腐蚀的过程中,锌电极是作为负极,利用原电池原理对钢铁形成保护;铝能增强抗腐蚀能力,可从金属活动性,形成保护膜,相同质量时提供电子的能力等角度加以分析。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目