网址:http://m.1010jiajiao.com/timu_id_258372[举报]
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
题 号
1
2
3
4
5
6
7
8
9
10
答 案
D
A
D
C
B
B
C
C
A
A
题 号
11
12
13
14
15
16
17
18
19
20
答 案
C
A
A
D
C
D
A
C
D
D
二、实验题: (本大题包括2小题,共18分)
21、(1)铁屑溶解,溶液逐渐变为浅绿色,有大量无色气泡产生(2分)
杂质Cu与Fe形成原电池,化学反应速率加快(2分)
(2)2FeC12+2HC1+H2O2=2FeC13+2H2O(2分)
(3)在HCl气氛中加热浓缩,冷却结晶,过滤(2分)
FeC13+3H2O Fe(OH)3 + 3HCl;直接加热时,FeC13水解会产生Fe(OH)3
(2分)
Fe(OH)3 + 3HCl;直接加热时,FeC13水解会产生Fe(OH)3
(2分)
(4)B(2分)
22、(1)A(2分) (2)2H++ 2e-= H2↑ (2分)
(3)2Fe3++ Fe = 3Fe2+ (2分)
三、填空题:(本大题共4小题。共36分)
23、(1)⑤⑥(2分) ①④⑧(2分)
(2)2Fe3++3CaCO3+3H2O = 2Fe(OH)3+3Ca2++3CO2↑ (2分)
或;2Fe3++3H2O Fe(OH)3+3H+ CaCO3+2H+ =
Ca2++H2O+3CO2↑
Fe(OH)3+3H+ CaCO3+2H+ =
Ca2++H2O+3CO2↑
(3)HCO3-+A1O2-+H2O=Al(OH)3↓+CO32-(2分)
24、(1)B(2分) ;
(2)CH3COONH4溶液呈中性,滴入Mg(OH)2 悬浊液,若Mg(OH)2溶解,则说明乙同学解释正确,若Mg(OH)2不溶,则甲同学解释正确。(2分)
(3)乙(2分);Mg(OH)2 + 2NH4+ ㄔ Mg2+ + 2NH3?H2O(2分)
25、(1)A、D(2分)
(2)用湿润的红色石蕊试纸放在管口处,若试纸变蓝说明有氨气生成。(2分)
(3)该反应是可逆反应,10mol N2与30mol H2不能完成反应,所以放出的热量小于924kJ。(2分)
(4)N2+6H++6e-=2NH3(2分)
26、(1)0.05(2分), 25 (2分)
(2) H2SO4与(NH4)2SO4(2分), (NH4)2SO4与NH3?H2O(2分)(本小题若其它合理答案也给分)
(3)=7 (2分) (4)BC (2分)
四、计算题:(本大题共6分)27、AgI(2分)、AgCl(2分)、4.1×10-14mol/L(2分)
附加题:
28、(1)BiCl3+H2O=BiOCl↓+2HCl(2分)
(2)不合理 (2分) 因BiOCl中Cl呈-1价而非+1(2分)
(3)将BiCl3溶于含适量HCl的蒸馏水中(2分)
(4)BiOCl+H2O BiOCl+2H++2Cl-,[Cl-]增大时,抑制了BiCl3水解(2分)
BiOCl+2H++2Cl-,[Cl-]增大时,抑制了BiCl3水解(2分)
29、(1) 正反应 (2分) 7.0 (2分)
(2) 不相等(2分) 因为这两种情况是在两个不同温度下达到化学平衡的(2分),平衡状态不同,所以物质的量也不同(2分)。
已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:Mg(OH)2(固)![]() Mg2++2OH…………①
Mg2++2OH…………①
NH4++H2O![]() NH3?H2O +H+…………② H++OH
NH3?H2O +H+…………② H++OH![]() H2O…………③
H2O…………③
由于NH4+水解显酸性,H+与OH反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:Mg(OH)2(固)![]() Mg2++2OH……① NH4++OH
Mg2++2OH……① NH4++OH![]() NH3?H2O……②
NH3?H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH结合,生成了弱的电解质NH3?H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3?H2O
(2)请你说明丙同学作出该选择的理由 。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
查看习题详情和答案>>已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性.现向少量的![]() 悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解.甲同学的解释是:
悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解.甲同学的解释是:
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
![]()
![]()
![]() ③
③
由于![]() 水解显酸性,
水解显酸性,![]() 与
与![]() 反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:
反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
由于![]() 电离出的
电离出的![]() 与
与![]() 电离出的
电离出的![]() 结合,生成了弱的电解质
结合,生成了弱的电解质![]() ,导致反应①的平衡右移,
,导致反应①的平衡右移,![]() 沉淀溶解.
沉淀溶解.
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是________(填写编号)。
A.![]()
B.![]()
C.![]()
D.![]()
(2)请你说明丙同学作出该选择的理由_________________________________________
_______________________________________.
(3)丙同学将所选试剂滴入![]() 的浊液中,
的浊液中,![]() 溶解;由此推知,甲和乙哪位同学的解释更合理________________(填“甲”或“乙”);完成
溶解;由此推知,甲和乙哪位同学的解释更合理________________(填“甲”或“乙”);完成![]() 饱和溶液使
饱和溶液使![]() 悬浊液溶解的离子方程式___________.
悬浊液溶解的离子方程式___________.
查看习题详情和答案>>
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
![]()
![]()
![]() ③
③
由于![]() 水解显酸性,
水解显酸性,![]() 与
与![]() 反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:
反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
由于![]() 电离出的
电离出的![]() 与
与![]() 电离出的
电离出的![]() 结合,生成了弱的电解质
结合,生成了弱的电解质![]() ,导致反应①的平衡右移,
,导致反应①的平衡右移,![]() 沉淀溶解.
沉淀溶解.
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是________(填写编号)。
A.![]()
B.![]()
C.![]()
D.![]()
(2)请你说明丙同学作出该选择的理由_________________________________________
_______________________________________.
(3)丙同学将所选试剂滴入![]() 的浊液中,
的浊液中,![]() 溶解;由此推知,甲和乙哪位同学的解释更合理________________(填“甲”或“乙”);完成
溶解;由此推知,甲和乙哪位同学的解释更合理________________(填“甲”或“乙”);完成![]() 饱和溶液使
饱和溶液使![]() 悬浊液溶解的离子方程式___________.
悬浊液溶解的离子方程式___________.
查看习题详情和答案>>
( 8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固)Mg2+(aq)+2OH—(aq)…………①
NH4++H2ONH3·H2O +H+…………② H++OH―
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固)Mg2+(aq)+2OH—(aq)……① NH4++OH―
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由 。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
查看习题详情和答案>>
( 8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固)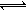 Mg2+(aq)+2OH—(aq)…………①
Mg2+(aq)+2OH—(aq)…………①
NH4++H2O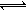 NH3·H2O +H+…………② H++OH―
NH3·H2O +H+…………② H++OH―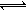 H2O…………③
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固)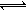 Mg2+(aq)+2OH—(aq)……① NH4++OH―
Mg2+(aq)+2OH—(aq)……① NH4++OH―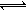 NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。 查看习题详情和答案>>