网址:http://m.1010jiajiao.com/timu_id_252142[举报]
二、选择题(48分)
13.C 14.ACD 15.AC 16.B 17.A 18.D
三、实验题(17分)
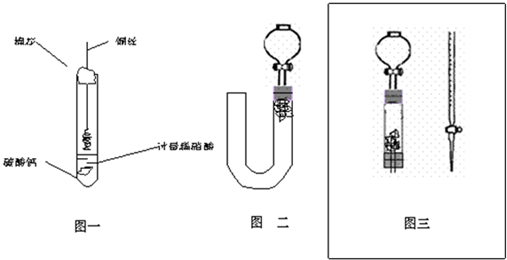
19、实验题
 ?)(8分)
?)(8分)
 (5分)
(5分)
连线如图(连线正确给3分,有任何错误不给这3分)
?)(9分)
(1) ② (2分) ③
(2分) ③ (2分) ④斜面倾角(或填h的数值)(2分)
(2分) ④斜面倾角(或填h的数值)(2分)
(2) 不能(3分)
20.
(1)由前三列数据可知物体在斜面上匀加速下滑时的加速度为a1==5m/s2,mg sin a=ma1,可得:a=30°,
(2)由后二列数据可知物体在水平面上匀减速滑行时的加速度大小为a2==2m/s2,mmg=ma2,可得:m=0.2,
(3)由2+5t=1.1+2(0.8-t),解得t=0.1s,即物体在斜面上下滑的时间为0.5s。
21.(18分)(1)设ab上产生的感应电动势为E,回路中电流为I,ab运动距离s所用的时间为t,则有:E=BLv I= t= Q=I2(4R)t 由上述方程得:v=
(2)设电容器两极板间的电势差为U,则有:U=IR
电容器所带电荷量q=CU 解得q=
22.(1)洛仑兹力不做功,由动能定理得,mgy= mv2
mv2 ……①
……①
得 v=
 ……②
……②
(2)设在最大距离ym处的速率为vm,根据圆周运动有,qvmB-mg=m ……③
……③
且由②知 
 ……④
……④
 由③④及R=2ym得
由③④及R=2ym得  ……⑤
……⑤
(3)小球运动如图所示,当它运动到最高点时速度最大,设为vm,此时小球在最高点的曲率半径也为该点到x轴距离的2倍,
由动能定理
(qE-mg)|ym|= ……⑥
……⑥
由圆周运动 qvmB+mg-qE=m ……⑦
……⑦
qE =2mg ……⑧
且由⑥⑦⑧及R=2|ym|解得vm=
28. D ③ 29. A ①
化学参考答案
一、选择题:(本题包括7小题,每题只有一个选项符合题意,每题6分,共42分)
6
7
8
9
10
11
12
C
B
A
D
C
B
C
二、(本题包括3小题,共35分)
23、(1)H2O2=HO2―+H+
(2)O2+2H2O+4e―→4OH―
(3)0.5mol
(4)2A1+2OH―+6H2O=2[A1(OH)4]―+3H2↑
(5)10―10mol?L―1c(NO3―)>c(NH4+)>c(H+)>c(OH―)
24(共16分,每空2分)
(1)否 硫酸溶质质量分数为23%<60%,其氧化性不突出所以无明显现象
(2)铜片慢慢溶解,带支管的试管中溶液渐成蓝色小试管中品红褪色。
化学方程式为:Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)现象是: ①液体呈浅蓝色,原因是溶液中含有Cu2+;②有白色固体在试管底部析出,
原因是:98%浓H2SO4有吸水性只剩无水CuSO4。
操作是:带支管的试管中的溶液冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒拌。
25.(1)① ,减小 ② 200℃,100
MPa 200℃时反应速率过低,压强过大对设备要求过高 ③B
(2)2NH3+60H--6e-=N2+6H2O 碱性 NH3在酸性介质中易转化为NH4+离子
,减小 ② 200℃,100
MPa 200℃时反应速率过低,压强过大对设备要求过高 ③B
(2)2NH3+60H--6e-=N2+6H2O 碱性 NH3在酸性介质中易转化为NH4+离子
【物质结构】
⑴第三周期 ⅦA 1s22s22p63s23p4 ⑵2Na+2H2O=2NaOH+H2↑ 大于
⑶大 SiO2是原子晶体或 小 CO2是分子晶体 (合理即给分)
⑷Cl高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强(合理即给分)
【有机化学】
(1)C4H6O5 羟基,羟基


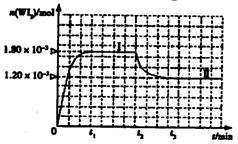

 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”


 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”