网址:http://m.1010jiajiao.com/timu_id_243586[举报]
题 号
1
2
3
4
5
6
7
8
9
答 案
D
D
B
C
C
D
C
B
B
题 号
10
11
12
13
14
15
16
17
答 案
A
C
D
B
D
B
B
A
18.(1)第三周期第VIA族(1分)
(2)CO2属于分子晶体而SiO2属于原子晶体(2分)
(3)NH3+HNO3 NH4NO3(2分)
(4)H2S、SiH4、C2H6、N2H4(写出3种即可)(3分)
 20
(10分 ) (每空2分)
20
(10分 ) (每空2分)
1、(NH4)2SO4 、 Ba(OH)2 + (NH4)2SO4 == BaSO4 + 2NH3↑+ 2H2O
2、AlO2-+ HCO3-==Al(OH)3↓+ CO2↑
3、Ca(HCO3)
21.(13分)
(1)① H2SO4(1分)。品红(1分);
生成的气体使品红褪色,并且加热后恢复红色,证明该产物是SO2 (2分)。

向盛有50mL 1.00mol?L-1HC1溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积
(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是 ( )
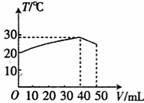
A.该实验表明化学能可以转化为热能 B.NaOH溶液的浓度大于1.00mol?L-1
C.V=50mL时,混合液的pH>7 D.该实验表明有水生成的反应都是放热反应
查看习题详情和答案>>如图:横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。
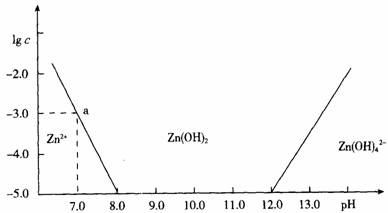
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:
__________________ 。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)== ____ 。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是 _ __ 。
(4)往1.00L 1.00mol?L―1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol
(5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
| C (HCl)/(mol?L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol?L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是 (填字母序号)
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol?L―1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
查看习题详情和答案>>