网址:http://m.1010jiajiao.com/timu_id_238613[举报]
一、(共69分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
C
A
D
D
C
D
C
B
B
A
B
题号
13
14
15
16
17
18
19
20
21
22
23
答案
C
B
C
A
C
A
B
A
B
D
C
二、(共15分)
24、A.Ⅰ⑴微量 儿童个头矮小、智力低下;甲状腺肿大、大脖子病等
⑵苯或四氯化碳等 ③⑥
⑶炒菜时不要先放盐或在烹饪快结束前再加入盐(每空1分,共5分)
Ⅱ⑷ C、H、O、N ⑸ C ⑹服用大量蛋清、牛奶或豆浆减缓毒性
⑺
 (每空1分,共5分)
(每空1分,共5分)
Ⅲ⑻Na+ Cl- 水体富营养化(或水华、赤潮等)(3分)
⑼2CaCO3+O2+2SO2=2CaSO4+2CO2(2分)
B.Ⅰ(每空2分,共8分)(1) 乙酸乙酯 (2) CH3COOH
(3)醛基 (4) CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
 Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
 ⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
三、(共16分)
25、(每空1分)
⑴ 第 2 周期 ⅠA 族
⑵A+D→B+C的离子方程式为 2Na+2H2O=2Na++2OH―+H2↑
G+I→H的离子方程式为 2Fe2++Cl2= 2Fe3++2Cl―
⑶ 溶液变成血红色 ⑷_____Ⅰ>Ⅲ>Ⅱ__
26.(1)不一定,因为碳酸银,硫酸银都是沉淀(2分) (2)NH4+ 0.8mol/L (2分)
(3)BaCO3 BaSO4 (2分)CO32- 0.04mol 、SO42- 0.02mol(2分)
(4)A(2分)
A.《化学与生活》
(1)食品和药品关系人的生存和健康.
①市场上销售的食盐品种很多.下列食盐中,所添加的元素不属于人体必需微量元素的是
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗
A.麻黄碱 B.阿司匹林 C.抗酸药
(2)蛋白质是生命的基础,没有蛋白质就没有生命.请回答下列问题:
①油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和
②人体摄入的蛋白质在胃蛋白酶和胰蛋白酶的作用下,水解成
③维生素C是一种重要维生素,能防治坏血病.用淀粉溶液、碘水为试剂,验证维生素C具有还原性的实验操作和现象是
(3)材料是人类赖以生存和发展的重要物质基础.
①普通玻璃是生活中常用的硅酸盐材料,其主要成分是Na2SiO3、CaSiO3和
| ||
| ||
②通常使用的钢铁是铁和
③天然橡胶(生胶)是线型高分子,因高分子链上有双键易老化,工业上常将它与含硫物质作用转变成为体型的网状分子的
B.《有机化学》
(1)有机物含有的官能团不同,性质也有差异.
①1mol下列有机物可与2mol溴单质发生加成反应的是
A.乙烯 B.乙炔 C.乙烷
②下列有机物中,核磁共振氢谱只有一个吸收峰的是
A.苯 B.苯酚 C.苯甲酸
③下列有机物中,能发生银镜反应的是
A.乙酸乙酯 B.乙醇 C.葡萄糖
(2)分子式为C4H10O,属于醇的同分异构体有




(3)科学家常采用将药物连接在高分子载体上,制成缓释长效药物.已知某种解热镇痛类药物,其结构简式如图甲,把它连接到高分子聚合物B上,形成缓释长效药物C如图乙.
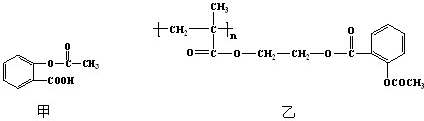
①分子聚合物B的结构简式为


②A与B反应生成C的有机反应类型是
③A可水解成


实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生.经检测,上述实验中产生的无色气体均为CO2.
请回答:
(1)请写出实验室制备氯气的离子方程式
(2)反应后所得的溶液漂白性增强的原因是

实验二、定量研究:
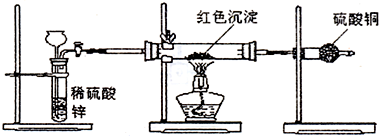
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体B L,发现
| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是
实验:
(1)(4分)右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

①该浓盐酸中HCl的物质的量浓度为_________mol·L-1 。[来源:学§科§网Z§X§X§K]
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________ 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D溶液的密度
(2).(8分)实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体_______g
② 若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线_________
B.忘记将洗涤液加入容量瓶__________
C.容量瓶内壁附有水珠而未干燥处理____________
D.溶解后没有冷却便进行定容______________
(3)(8分)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为______________,反应后得到黄色的FeCl3溶液。用此溶液做以下实验:
②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为____________________________________。
③在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3饱和溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
④另取一小烧杯加入25 mL蒸馏水后,向烧杯中再加入2 mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到________(填甲或乙)烧杯中会产生丁达尔效应。此实验可以区别
查看习题详情和答案>>
(1)欲量取20.00mL Na2CO3溶液,应选用的仪器是
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
(3)在测定硫酸铜晶体中含量的实验中,称量操作至少要进行
Ⅱ.氢氧化铜是一种常用试剂.例如,利用新制氢氧化铜验证醛类物质的还原性.
(1)新制氢氧化铜悬浊液的配制,实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡即成.这样操作的目的是
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:提出猜想:
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应:③在空气中灼烧氧化亚铜生成氧化铜.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出.
你认为合理的方案是
(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示.你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):
①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
(4)研究性学习小组丙上网查阅新闻得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂-蓝矾.请你帮助他们设计一个简单且符合绿色化学要求的实验方案:
 中新网2009年5月21日电:据法新社报道,世界卫生组织宣布全球感染甲型H1N1流感患者已升至11034人.根据所有的资料显示,“达菲”是国际上公认的治疗流感的药物之一.广东省中医院呼吸内科主任林琳教授解释,目前我们常用的抗病毒药有两大类,一个是金刚烷胺类药物,另一个是神经氨酸酶抑制剂类药物.据现在研究的情况,甲型H1N1流感病毒对金刚烷胺类药物不敏感,而对神经氨酸酶抑制剂类药物如达菲还是敏感的.
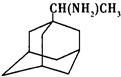
中新网2009年5月21日电:据法新社报道,世界卫生组织宣布全球感染甲型H1N1流感患者已升至11034人.根据所有的资料显示,“达菲”是国际上公认的治疗流感的药物之一.广东省中医院呼吸内科主任林琳教授解释,目前我们常用的抗病毒药有两大类,一个是金刚烷胺类药物,另一个是神经氨酸酶抑制剂类药物.据现在研究的情况,甲型H1N1流感病毒对金刚烷胺类药物不敏感,而对神经氨酸酶抑制剂类药物如达菲还是敏感的.(1)金刚乙胺,又名α-甲基-1-金刚烷甲基胺,其化学结构简式如右图所示.金刚乙胺是金刚乙烷的衍生物,金刚乙烷有很多衍生物,它们可以相互衍变.下图就是它的部分衍生物相互衍变图.
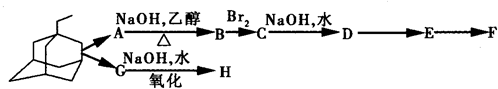
经检测发现,E分子中有两个C=O键,但与新制氢氧化铜反应得不到红色沉淀;1mol F与足量的钠完全反应生成22.4L气体(标况);H具有酸性,且分子式中只比F少1个O.据此回答下列问题:(可用“R”表示
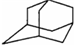 )
)①写出H的结构简式:
②写出C→D的化学方程式:
③F在一定条件下,可发生缩聚反应,形成高分子化合物I,试写出I的结构简式:


④金刚乙烷在一定条件下可发生氯取代,其一氯取代物有
(2)达菲的生产原材料是八角中所含的一种重要成分莽草酸,它的球棍结构模型如下图所示:下列关于莽草酸的说法正确的是
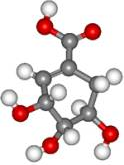
A.分子式为C7H10O5,能溶于水,遇FeCl3溶液呈紫色
B.该化合物可以使溴水褪色
C.该化合物既具有酸性,又具有碱性
D.该化合物既可发生消去反应,也可被催化氧化生成醛
E.该化合物的分子中处于同一平面的原子只有4个.