网址:http://m.1010jiajiao.com/timu_id_238554[举报]
一、(共69分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
C
A
D
D
C
D
C
B
B
A
B
题号
13
14
15
16
17
18
19
20
21
22
23
答案
C
B
C
A
C
A
B
A
B
D
C
二、(共15分)
24、A.Ⅰ⑴微量 儿童个头矮小、智力低下;甲状腺肿大、大脖子病等
⑵苯或四氯化碳等 ③⑥
⑶炒菜时不要先放盐或在烹饪快结束前再加入盐(每空1分,共5分)
Ⅱ⑷ C、H、O、N ⑸ C ⑹服用大量蛋清、牛奶或豆浆减缓毒性
⑺
 (每空1分,共5分)
(每空1分,共5分)
Ⅲ⑻Na+ Cl- 水体富营养化(或水华、赤潮等)(3分)
⑼2CaCO3+O2+2SO2=2CaSO4+2CO2(2分)
B.Ⅰ(每空2分,共8分)(1) 乙酸乙酯 (2) CH3COOH
(3)醛基 (4) CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
 Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
 ⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
三、(共16分)
25、(每空1分)
⑴ 第 2 周期 ⅠA 族
⑵A+D→B+C的离子方程式为 2Na+2H2O=2Na++2OH―+H2↑
G+I→H的离子方程式为 2Fe2++Cl2= 2Fe3++2Cl―
⑶ 溶液变成血红色 ⑷_____Ⅰ>Ⅲ>Ⅱ__
26.(1)不一定,因为碳酸银,硫酸银都是沉淀(2分) (2)NH4+ 0.8mol/L (2分)
(3)BaCO3 BaSO4 (2分)CO32- 0.04mol 、SO42- 0.02mol(2分)
(4)A(2分)
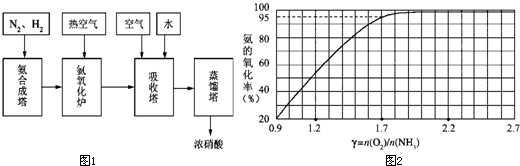
(1)已知反应一经发生,铂铑合金网就会处于红热状态.写出氨催化氧化的化学方程式:
| ||
| △ |
| ||
| △ |
(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=a kJ?mol-1
N2(g)+2O2(g)=2NO2(g)△H=b kJ?mol-1
H2O(l)=H2O(g)△H=c kJ?mol-1
则反应2NO2(g)+4H2(g)=N2(g)+4H2O(l)的△H=
(3)①氨气是制取硝酸的重要原料,合成氨反应的化学方程式为N2+3H2
| ||
| 高温高压 |
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.3v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.1mol N≡N键断裂,同时1mol H-H键断裂
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L的固定容积的密闭容器中,5min后反应达平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,则反应速率v(N2)=
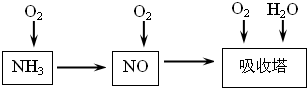
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2![]() 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.![]()
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。
查看习题详情和答案>>
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2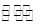 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8 mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。
查看习题详情和答案>>
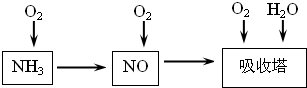
 2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是______(填序号)
2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是______(填序号)