��Ŀ����
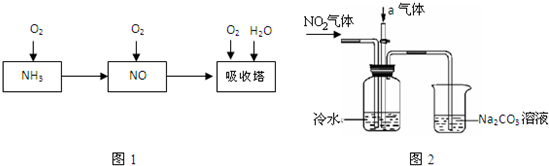
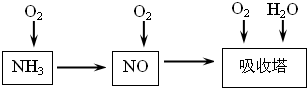
��14�֣���ҵ������Ϊԭ�ϣ�����Ͻ���Ϊ��������������������Ĺ������£�

��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ �����¶�����ʱ����ѧƽ�ⳣ��Kֵ �����������С��������Ӱ�족����
��2�����᳧β�����õĴ��������ǣ�����ԭ������������ʱ��H2��NO2��ԭΪN2��
��֪��2H2��g��+O2��g��=2H2O��g����H=-483��6 kJ��mol
N2��g��+2O2��g��=2NO2��g�� ��H=+67��7 kJ��mol
H2O��1��=H2O��g�� ��H=+44��0 kJ��mol
��8g H2ǡ�ý�NO2ת����N2��H2O��1��ʱ��H= ��
��3����������ȡ�������Ҫԭ�ϣ��ϳɰ���Ӧ�Ļ�ѧ����ʽ���£�N2+3H2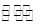 2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С�
2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С�
�����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ����
A��������N2��H2��NH3��Ũ��֮��Ϊl��3��2
B��
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
�����ں��������£���N2��H2��һ���������ͨ��һ���ݻ�Ϊ2 L�̶��ݻ����ܱ������У�5 min��Ӧ��ƽ��ʱ��n��N2��=1��2 mol��n��H2��=1��2 mol�� n��NH3��=0��8 mol����Ӧ����v��N2��= ��ƽ�ⳣ��= ��������λС�������������������¶Ⱥ��ݻ����䣬������ƽ����ϵ�еĻ�������Ũ������1������ƽ�� �����������һ��ƶ����ƶ���
��1��4NH3+5O2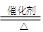 4NO+6H2O ��2�֣���С��2�֣���2����1210.9 kJ/mol��2�֣�
4NO+6H2O ��2�֣���С��2�֣���2����1210.9 kJ/mol��2�֣�
��3����BC��2�֣���0.04mol��L-1��min-1��2�֣� 1.23��2�֣����ң�2�֣�
�����������⿼�黯ѧ��Ӧ�е������仯�ͻ�ѧ��Ӧ���ʺͻ�ѧƽ����йؼ��㡣
��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ4NH3+5O2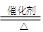 4NO+6H2O�������³ɰ���Ӧ�Ƿ��ȷ�Ӧ���¶�����ƽ�����淴Ӧ������У�ƽ�ⳣ��ֵ��С��
4NO+6H2O�������³ɰ���Ӧ�Ƿ��ȷ�Ӧ���¶�����ƽ�����淴Ӧ������У�ƽ�ⳣ��ֵ��С��
��2����H2��NO2��ԭΪN2�ķ���ʽΪ2NO2��g��+4H2��g��= N2��g��+4H2O��l��������֪��Ӧ2H2��g��+O2��g��=2H2O��g����H=-483��6 kJ��mol��N2��g��+2O2��g��=2NO2��g����H=+67��7 kJ��mol��H2O��1��=H2O��g����H=+44��0 kJ��mol�ۣ����ݸ�˹���ɣ�2����-��-4���ۿɵ�2NO2��g��+4H2��g��= N2��g��+4H2O����H=��1210.9kJ/mol����8g H2ǡ�ý�NO2ת����N2��H2O��1��ʱ��H=��1210.9kJ/mol��
��3�����жϴﵽƽ��ı�־�ǡ���ı���������ˣ��ʹﵽ��ƽ��״̬������A��D�������⣬���ڷ�Ӧ������������䣬�ʷ�Ӧǰ����������ܶȱ��ֲ��䣬������ı������
�� �ȼ���V(NH3)=(0��8 mol/2L)/5min=0.08mol��L-1��min-1,������֮�ȵ��ڼ�����֮�ȿ�֪��V(N2)= V(NH3)/2=0.04mol��L-1��min-1��ƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(N2)= 1��2 mol/2L=0.6 mol/L��c(H2)= 1��2 mol/2L=0.6 mol/L��c(NH3)= 0��8 mol/2L=0.4mol/L����K= c2(NH3)/[ c(N2) ��c3(H2)]= 0.42/(0.6������������Ч��3)= 1.23���������������¶Ⱥ��ݻ����䣬������ƽ����ϵ�еĻ�������Ũ������1������Q== c2(NH3)/[ c(N2) ��c3(H2)]= 0.82/(1.2��1.23)= 0.38<K����ƽ�������ƶ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�