摘要:(3)CuSO4总反应式:2CuSO4+2H2O 2Cu+2H2SO4+O2↑
网址:http://m.1010jiajiao.com/timu_id_234219[举报]
I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应.向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快.
乙组:Cu
CuO
CuSO4
丙组:Cu
Cu(NO3)2
Cu(OH)2
CuSO4
丁组:Cu
CuSO4
(1)甲组实验用一个化学反应方程式表示:
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染.则在四组方案中,
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:CuSO4
CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.

实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;②实验结束时干燥管D总质量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL.试回答下列问题:
(3)装置B的作用是
(4)装置C的作用是
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温,②调节量筒使其液面与E装置中的液面持平,③
(6)通过计算,推断出该条件下反应的化学方程式
查看习题详情和答案>>
甲组:将铜粉投入盛有稀硫酸的容器中,无反应.向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快.
乙组:Cu
| ||
| △ |
| ||
| △ |
丙组:Cu
| 硝酸银 |
| 氢氧化钠 |
| 稀H2SO4 |
丁组:Cu
| ||
| △ |
(1)甲组实验用一个化学反应方程式表示:
2Cu+O2+2H2SO4=2CuSO4+2H2O
2Cu+O2+2H2SO4=2CuSO4+2H2O
;使反应变快的可能原因是;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的实验操作步骤应为加热蒸发
加热蒸发
、结晶冷却
结晶冷却
、过滤并洗涤晶体,取得产品后的残留物质可循环使用.(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染.则在四组方案中,
甲
甲
组方案最好.II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:CuSO4
| ||

实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;②实验结束时干燥管D总质量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL.试回答下列问题:
(3)装置B的作用是
吸收SO3,放出等物质的量的SO2
吸收SO3,放出等物质的量的SO2
.(4)装置C的作用是
吸收水分干燥SO2和O2
吸收水分干燥SO2和O2
.(5)为减少测量气体体积引起的误差,应注意的事项有:
此处不填
此处不填
①装置内气体的温度应恢复到室温,②调节量筒使其液面与E装置中的液面持平,③
读量筒中液体体积时,视线与液体的凹液面相平;
读量筒中液体体积时,视线与液体的凹液面相平;
(6)通过计算,推断出该条件下反应的化学方程式
3CuSO4
3CuO+2SO2↑+SO3↑+O2↑
| ||
3CuSO4
3CuO+2SO2↑+SO3↑+O2↑
.
| ||
据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐.发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是
(2)工业生产中利用上述反应后的溶液,按如下流程图1可制备胆矾(CuSO4?5H2O):
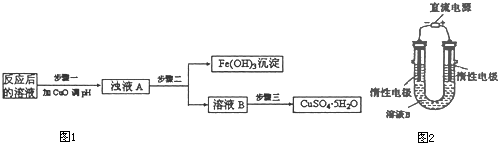
①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
步骤一应调节溶液的pH范围是
②步骤三中的具体操作方法是
(3)有人提出可以利用图2的装置从溶液B中提炼金属铜.该过程中右边电极的反应式是
(4)工业上冶炼铜的方法之一为:Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+
O2(g)=Cu2O(s)△H=-12kJ?mol-1
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ?mol-1
③S(s)+O2(g)=SO2(g)△H=-296.8kJ?mol-1
则该法冶炼铜的反应中△H=
查看习题详情和答案>>
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是
Fe和CuFeS2中的S
Fe和CuFeS2中的S
.(2)工业生产中利用上述反应后的溶液,按如下流程图1可制备胆矾(CuSO4?5H2O):

①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
3.2≤pH<4.7
3.2≤pH<4.7
.请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因加入CuO与H+反应使c(H+)减小,c(OH-)增大,使溶液中c(Fe3+)?c3(OH-)>Ksp[Fe(OH)3],导致Fe3+生成沉淀而除去
加入CuO与H+反应使c(H+)减小,c(OH-)增大,使溶液中c(Fe3+)?c3(OH-)>Ksp[Fe(OH)3],导致Fe3+生成沉淀而除去
.②步骤三中的具体操作方法是
蒸发浓缩,冷却结晶
蒸发浓缩,冷却结晶
.(3)有人提出可以利用图2的装置从溶液B中提炼金属铜.该过程中右边电极的反应式是
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,总反应的方程式是2CuSO4+2H2O
2Cu+2H2SO4+O2↑
| ||
2CuSO4+2H2O
2Cu+2H2SO4+O2↑
.
| ||
(4)工业上冶炼铜的方法之一为:Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+
| 1 |
| 2 |
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ?mol-1
③S(s)+O2(g)=SO2(g)△H=-296.8kJ?mol-1
则该法冶炼铜的反应中△H=
-193.3kJ?mol-1
-193.3kJ?mol-1
.(2009?滨州模拟)Ⅰ.化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究.甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应.他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置有些铂丝,反应速率明显加快.此时,其他组的同学提出方案如下:
乙组:Cu
CuO
CuSO4
丙组:Cu
CuSO4
丁组:Cu
Cu(NO3)2
Cu(OH)2
CuSO4
戊组:Cu
CuSO4
(1)甲组试验可用一个化学反应方程式表示为
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染.则在五组方案中,有科学性错误的是
Ⅱ.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
CuSO4
CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
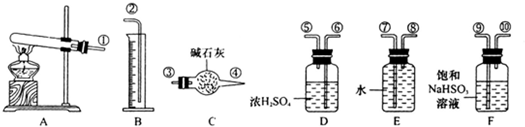
试验测得数据及有关结果如下;
①准确称取6.0g无水CuSO4;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3.按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(1)装置F的作用是
(2)装置D的作用是
(3)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温.
②
③
(4)通过计算,推断出该条件下反应的化学方程式
查看习题详情和答案>>
乙组:Cu
| 氧气 |
| △ |
| 稀H2SO4 |
丙组:Cu
| 硫酸亚铁 |
丁组:Cu
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
戊组:Cu
| 浓H2SO4 |
| △ |
(1)甲组试验可用一个化学反应方程式表示为
2Cu+O2+2H2SO4=2CuSO4+2H2O
2Cu+O2+2H2SO4=2CuSO4+2H2O
;使反应变快的可能原因是形成了原电池
形成了原电池
;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的试验操作步骤应为加热蒸发;
加热蒸发;
、冷却结晶
冷却结晶
、过滤并洗涤晶体
过滤并洗涤晶体
,取得产品后的残留物质可循环使用.(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染.则在五组方案中,有科学性错误的是
丙
丙
组方案,有污染的是戊
戊
组方案,无污染但能量消耗较高的是乙
乙
组方案,因此选择甲
甲
组方案最好.Ⅱ.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
CuSO4
| △ |

试验测得数据及有关结果如下;
①准确称取6.0g无水CuSO4;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3.按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(1)装置F的作用是
吸收SO3,放出等物质的量的SO2
吸收SO3,放出等物质的量的SO2
.(2)装置D的作用是
吸收水分,干燥SO2和O2
吸收水分,干燥SO2和O2
.(3)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温.
②
调节量筒使其液面与E装置中的液面持平
调节量筒使其液面与E装置中的液面持平
,③
读曲量筒中液体体积时,视线与液体的凹液面相平
读曲量筒中液体体积时,视线与液体的凹液面相平
.(4)通过计算,推断出该条件下反应的化学方程式
3CuSO4
3CuO+2SO2↑+SO3↑+O2↑
| ||
3CuSO4
3CuO+2SO2↑+SO3↑+O2↑
.
| ||
用石墨做电极电解:①稀H2SO4 ②K2SO4溶液 ③CuCl2溶液 ④CuSO4 溶液 ⑤KOH溶液.
(1)阴阳极都有气体产生,且体积比(相同条件下)为2:1的是
(2)阴极.阳极都有气体产生,其中溶液的pH变小的是
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是
查看习题详情和答案>>
(1)阴阳极都有气体产生,且体积比(相同条件下)为2:1的是
①②⑤
①②⑤
(填序号,下同),其阳极的电极反应式都是4OH-→O2↑+2H2O+4e-
4OH-→O2↑+2H2O+4e-
,阴极的电极反应式都是4H++4e-→2H2↑
4H++4e-→2H2↑
,总反应的化学方程式是2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
.
| ||
(2)阴极.阳极都有气体产生,其中溶液的pH变小的是
①
①
,pH变大的是⑤
⑤
.(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是
④
④
,其总反应的化学方程式是2CuSO4+2H2O
2Cu+O2↑+2H2SO4
| ||
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
.
| ||
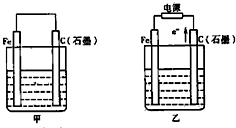 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为
2H2O+O2+4e-═4OH-
2H2O+O2+4e-═4OH-
;②乙中总反应的离子方程式为
2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
;
| ||
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为
5Cl2+I2+6H2O═10HCl+2HIO3
5Cl2+I2+6H2O═10HCl+2HIO3
.(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为
Fe-2e-═Fe2+
Fe-2e-═Fe2+
;②乙中Fe电极是
阴极
阴极
(填阳极或阴极),总反应式是2CuSO4+2H2O
2Cu+O2↑+2H2SO4
| ||
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
,电解一段时间后溶液PH将
| ||
减小
减小
(填增大、减小或不变)