摘要:2.弱碱溶液的pH
网址:http://m.1010jiajiao.com/timu_id_233628[举报]
某溶液的pH=2,若向该溶液中加水到原来溶液体积的10倍,所得溶液的pH:3>pH>2,则该物质可能是( )
①强酸 ②弱酸 ③强酸弱碱盐 ④强碱弱酸盐
A.② B.③④ C.②③ D.①④
查看习题详情和答案>>对溶液的研究和认识,在生产、生活和科研领域具有重要意义.
(1)现有一种含有弱酸HA和其钠盐NaA的溶液,请回答下列问题:
①组成该溶液的微观粒子有 .
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是 ;
③若向该溶液中逐滴加入KOH溶液时,下列图象能表示Aˉ离子数目变化趋势的是 ;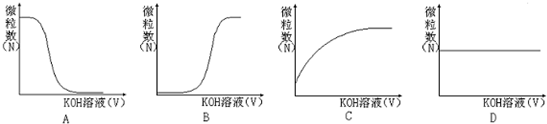
④现将1体积0.04mol?L-1HA溶液和1体积0.02mol?L-1NaOH溶液混合,得到2体积混合溶液.若该混合液显碱性,则其c(A-) 0.01mol?L-1(填“<”、“=”或“>”);若该混合液显酸性,溶液中所有离子的浓度由大到小的顺序是 .
(2)血液里含有的H2CO3和NaHCO3,与上述情况相似,对保持血液pH的稳定起到重要作用.
当c(H+)增大时,血液中消耗H+的离子方程式为 ;
当c(OH-)增大时,血液的pH也能保持基本稳定,试结合离子方程式简要说明 .
查看习题详情和答案>>
(1)现有一种含有弱酸HA和其钠盐NaA的溶液,请回答下列问题:
①组成该溶液的微观粒子有
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是
③若向该溶液中逐滴加入KOH溶液时,下列图象能表示Aˉ离子数目变化趋势的是

④现将1体积0.04mol?L-1HA溶液和1体积0.02mol?L-1NaOH溶液混合,得到2体积混合溶液.若该混合液显碱性,则其c(A-)
(2)血液里含有的H2CO3和NaHCO3,与上述情况相似,对保持血液pH的稳定起到重要作用.
当c(H+)增大时,血液中消耗H+的离子方程式为
当c(OH-)增大时,血液的pH也能保持基本稳定,试结合离子方程式简要说明
对于溶液的pH,下列说法正确的是( )
A.pH=5的HCl加水稀释1000倍后,溶液pH=8
B.pH=5的CH3COOH溶液比pH=6的HCl溶液的导电性弱
C.一种c(H+)=1×10-3 mol/L的一元酸溶液和一种c(OH-)=1×10-3mol/L的一元碱溶液等体积混合后溶液呈中性,生成的盐一定是强酸强碱盐
D.若醋酸溶液的pH=3,氢氧化钠溶液的pH=11,则醋酸溶液中的c(CH3COO-)与氢氧化钠钠溶液中的c(Na+)相同
查看习题详情和答案>>