摘要:例7 ①常温下.求0.1mol/L氢氧化钠溶液的pH.
网址:http://m.1010jiajiao.com/timu_id_233625[举报]
常温下有浓度均为0.1mol·L-1的四种溶液:①碳酸钠溶液;②碳酸氢钠溶液;③盐酸;④氨水。请根据题目要求回答下列问题。
(1) 上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是__________。
(2) 取适量溶液④,加入少量氯化铵固体,此时溶液中 ![]() 的值_____(填“增大” 或“减小”或“不变”)。
的值_____(填“增大” 或“减小”或“不变”)。
(3) 将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是:__________。 所得溶液的pH<7,用离子方程式表示其原因________________;混合后的溶液中由水电 离
出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(4) 取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出c(H+)=________________。
(5) 若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是__________。
(6) 有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.CH3COONH4;C.(NH4)2SO4; D.NH4Cl, 按pH由大到小的顺序排列_______ _(填序号)
查看习题详情和答案>> 常温下有浓度均为0.1mol?L-1的四种溶液:①碳酸钠溶液;②碳酸氢钠溶液;③盐酸;④氨水.请根据题目要求回答下列问题.
常温下有浓度均为0.1mol?L-1的四种溶液:①碳酸钠溶液;②碳酸氢钠溶液;③盐酸;④氨水.请根据题目要求回答下列问题.(1)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是
②
②
.(2)取适量溶液④,加入少量氯化铵固体,此时溶液中
| c(OH-) | c(NH3?H2O) |
减小
减小
(填“增大”或“减小”或“不变”).(3)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
. 所得溶液的pH<7,用离子方程式表示其原因NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
;混合后的溶液中由水电 离出的c(OH-)
>
>
0.1mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”).(4)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出c(H+)=
5×10-12
5×10-12
.(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
.(6)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.CH3COONH4;C.(NH4)2SO4; D.NH4Cl,按pH由大到小的顺序排列
ABDC
ABDC
(填序号)
常温下有浓度均为0.1mol?L-1的四种溶液:①碳酸钠溶液;②碳酸氢钠溶液;③盐酸;④氨水.请根据题目要求回答下列问题.
(1)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是______.
(2)取适量溶液④,加入少量氯化铵固体,此时溶液中 的值______(填“增大”或“减小”或“不变”).
的值______(填“增大”或“减小”或“不变”).
(3)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是:______. 所得溶液的pH<7,用离子方程式表示其原因______;混合后的溶液中由水电 离
出的c(OH-)______0.1mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”).
(4)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出c(H+)=______.
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是______.
(6)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.CH3COONH4;C.(NH4)2SO4; D.NH4Cl,按pH由大到小的顺序排列______(填序号)
 查看习题详情和答案>>
查看习题详情和答案>>
(1)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是______.
(2)取适量溶液④,加入少量氯化铵固体,此时溶液中
 的值______(填“增大”或“减小”或“不变”).
的值______(填“增大”或“减小”或“不变”).(3)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是:______. 所得溶液的pH<7,用离子方程式表示其原因______;混合后的溶液中由水电 离
出的c(OH-)______0.1mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”).
(4)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出c(H+)=______.
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是______.
(6)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.CH3COONH4;C.(NH4)2SO4; D.NH4Cl,按pH由大到小的顺序排列______(填序号)
 查看习题详情和答案>>
查看习题详情和答案>>
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2.
则NO2在上述过程中的作用与H2SO4在下述变化中的作用相似的是______.
?A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
?C.亚硫酸钠固体中加入H2SO4 D.制备乙酸乙酯时加入浓H2SO4
(2)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.
?①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______,其水解反应的平衡常数(即水解常数)的表达式为Kh=______.
?②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=______.
?③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=______[用含c(HCO-3)、c(H2CO3)的关系式表示].
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
若在一定温度下,将2molNO、lmolCO充入固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=______(结果保留两位有效数字).该温度下,反应的化学平衡常数为:K=______(用分数表示).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④
 查看习题详情和答案>>
查看习题详情和答案>>
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2.
则NO2在上述过程中的作用与H2SO4在下述变化中的作用相似的是______.
?A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
?C.亚硫酸钠固体中加入H2SO4 D.制备乙酸乙酯时加入浓H2SO4
(2)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.
?①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______,其水解反应的平衡常数(即水解常数)的表达式为Kh=______.
?②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=______.
?③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=______[用含c(HCO-3)、c(H2CO3)的关系式表示].
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
若在一定温度下,将2molNO、lmolCO充入固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=______(结果保留两位有效数字).该温度下,反应的化学平衡常数为:K=______(用分数表示).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④
 查看习题详情和答案>>
查看习题详情和答案>>
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2.
则NO2在上述过程中的作用与H2SO4在下述变化中的作用相似的是______.
?A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
?C.亚硫酸钠固体中加入H2SO4 D.制备乙酸乙酯时加入浓H2SO4
(2)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.
?①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______,其水解反应的平衡常数(即水解常数)的表达式为Kh=______.
?②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=______.
?③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=______[用含c(HCO-3)、c(H2CO3)的关系式表示].
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
若在一定温度下,将2molNO、lmolCO充入固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=______(结果保留两位有效数字).该温度下,反应的化学平衡常数为:K=______(用分数表示).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④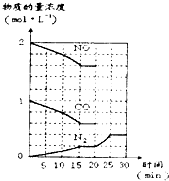
查看习题详情和答案>>
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2.
则NO2在上述过程中的作用与H2SO4在下述变化中的作用相似的是______.
?A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
?C.亚硫酸钠固体中加入H2SO4 D.制备乙酸乙酯时加入浓H2SO4
(2)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.
?①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______,其水解反应的平衡常数(即水解常数)的表达式为Kh=______.
?②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=______.
?③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=______[用含c(HCO-3)、c(H2CO3)的关系式表示].
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
若在一定温度下,将2molNO、lmolCO充入固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=______(结果保留两位有效数字).该温度下,反应的化学平衡常数为:K=______(用分数表示).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④
