网址:http://m.1010jiajiao.com/timu_id_231840[举报]
(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:

(1) 用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
(2) 利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。向容器①中通人氢气的目的是 。
待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 ②中继续产生的氢气会将 (填①、②或③,后同)容器中的溶液压入① 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
(3) 为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:

②滴定时,将KMnO4溶液装在 (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
查看习题详情和答案>>
(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1) 用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
(2) 利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。向容器①中通人氢气的目的是 。
待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 ②中继续产生的氢气会将 (填①、②或③,后同)容器中的溶液压入① 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
(3) 为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:
②滴定时,将KMnO4溶液装在 (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
查看习题详情和答案>>
(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1) 用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
(2) 利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。向容器①中通人氢气的目的是 。
待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 ②中继续产生的氢气会将 (填①、②或③,后同)容器中的溶液压入① 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
(3) 为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:
②滴定时,将KMnO4溶液装在 (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
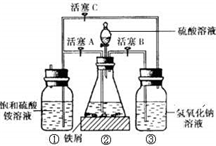 摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
①试配平反应的离子方程式:
②滴定时,将KMnO4溶液装在
③产品中摩尔盐的质量分数
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
(2)步骤2、步骤3的实验目的都是
(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:
(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是: