网址:http://m.1010jiajiao.com/timu_id_230201[举报]
一、选择题:选对的给6分,选错或未选的给0分。
1―5 B 、C、D 、D 、A 6―12 B、C 、C 、A 、A 、D 、B
二、选择题:全部选对的给6分,选不全的给3分,有选错的或未选的给0分。
 13.B 14.AC 15.CD 16.A 17.C 18.B
13.B 14.AC 15.CD 16.A 17.C 18.B
第Ⅱ卷必考部分共9题,共157分。
 19.(18分)
19.(18分)
(1)1(2分),0.15(2分)
(2)①如图甲所示;(2分)
②如图乙所示 (4分)
③ 8.7(2分);172(2分)
20.(15分)
(1)0.6s。最长的反应时间,对应刹车之前最大可能运动距离。(4分)
(2)0.32。最小的动摩擦因数,对应最大的刹车距离。(4分)
(3)考虑最高车速v、最长反应时间t及最小动摩擦因数μ的极限情况。
因汽车在驾驶员反应时间t内匀速行驶距离为
 (2分)
(2分)
刹车后,汽车做减速运动,加速度大小为

汽车减速过程行驶距离为  (3分)
(3分)
所以  ,因此
,因此
21.(19分)
(1)小球从开始自由下落到到达管口B的过程中机械能守恒,故有:
 (2分) 到达B点时速度大小为
(2分) 到达B点时速度大小为 (1分)
(1分)
(2) 设电场力的竖直分力为Fy、,水平分力为Fx,则Fy=mg(方向竖直向上)。小球从B运动到C的过程中,由动能定理得:
 (2分)
(2分)
小球从管口C处脱离圆管后,做类平抛运动,由于其轨迹经过A点,有
 (2分)
(2分)
 (2分)
(2分)
联立解得: Fx=mg (1分)
电场力的大小为:  (1分)
(1分)
设电场力的合力方向与水平方向成 角,则
角,则 (1分)
(1分)
小球所受电场力方向与水平方向间的夹角 (1分)
(1分)
(3)小球经过管口C处时,向心力由Fx和圆管的弹力N提供,设弹力N的方向向左,则
 (2分)
(2分)
解得:N=3mg(方向向左) (2分)
根据牛顿第三定律可知,  ,方向水平向右 (2分)
,方向水平向右 (2分)
22.(20分)
(1)粒子绕行n圈获得的动能等于电场力对粒子做的功,设粒子绕行n圈获得的速度为 ,根据动能定理,
,根据动能定理,
由  (4分) 解得
(4分) 解得  (2分)
(2分)
粒子在环形区域磁场中,受洛伦兹力作用做半径为R的匀速圆周运动,根据牛顿第二定律和向心力公式,得  (4分) 解得
(4分) 解得  (2分)
(2分)
(2)粒子绕行第n圈所需时间
 (4分)
(4分)
粒子绕行n圈所需总时间为
 (4分)
(4分)
23.(15分)
(1)氢; (2分)
:N
 N:
(2分)
N:
(2分)
(2)杀菌消毒(合理的都可以) (2分)
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O (3分)
(3)2:3 (2分)
(4)酸性 (2分)
c(NO3-)>c(NH4+)>c(H+)>c(OH-) (2分)
24.(15分)
(1)普通漏斗 (2分)
pH试纸 (2分)
(2)用玻璃棒蘸取溶解固体所得溶液于pH试纸上,若溶液呈强酸性则硫酸已过量。 (3分)
(3)偏高 (2分)
(4)将加热后的固体置于干燥器中冷却后称量 。 (3分)
(5)确定固体混合物中的铜氧化完全 。 (3分)
25.(15分)
⑴ 加压有利于平衡正向移动,提高原料气的转化率 (2分)
增加反应速率,缩短达到平衡的时间 (2分)
⑵  (3分)
(3分)
? (2分)
⑶ CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ?mol-1 (3分)
-483.6 (3分)
26.(24分)
Ⅰ.(1)酶 ATP 半保留复制 (各2分,共6分)
(2)100% 1/8 (各2分,共4分)
(3)碱基互补配对原则 (2分)
Ⅱ.(1)基因突变 环境因素 (各2分,共4分)
(2)让矮化植株与原始亲本进行杂交 (2分)
如果F1表现为高茎,说明矮茎性状是隐性突变; (2分)
如果F1既有高茎,又有矮茎,或F1全是矮茎,说明矮茎性状是显性突变。(2分)
(3)配子 (2分)
27. (16分 )
I.三---------(2分) 上→下------(2分)
II. ②不同颜色的单侧光对小苗向光性的弯曲程度的影响随波长的增大而减弱;(2分)
③不同颜色的单侧光对小苗向光性的弯曲程度的影响随波长的增大而增强;(2分)
④不同颜色的单侧光对小苗向光性的弯曲程度的影响先随波长的增大而增强,当达到最大值时随波长的增大而减弱;(2分)
III.取生长状况一致的玉米胚芽鞘尖端若干(2分)
胚芽鞘甲和胚芽鞘乙的弯曲程度(2分)
胚芽鞘甲比胚芽鞘乙的弯曲程度大,说明小苗在单侧光蓝光下弯曲的程度大于小苗在单侧光红光下的弯曲程度(2分)
第Ⅱ卷选考部分共5题,共35分。
28.(12分)(1)② (2) ③ (各6分,共12分)
29.(12分)(1)② (2) ③ (各6分,共12分)
30.(13分)
⑴1s22s22p63s23p6 3d64s2 (2分)
⑵ ① 具有孤对电子 (2分)
② Fe2+ (2分)
⑶ 分子晶体 (2分)
A或共价键 (2分)
⑷ 2∶1 (3分)
31.(13分)
 (1)
(各2分,共4分)
(1)
(各2分,共4分)
(2)消去反应、取代反应。 (各1分,共2分)
 (3)
( 3分)
(3)
( 3分)

 (4)
(4)
(结构符合要求便给分) (各2分,共4分)
32.(10分)
(1)目的基因的检测和鉴定 (2分)
(2)限制性内切酶、DNA连接酶 (只答一个不给分) (2分)
终止子 标记基因 (各2分,共4分)
(3)不能 皮肤细胞中的胰岛素基因未表达,不能形成胰岛素mRNA。
(2分)
问题1:铁为何称为黑色金属?
(1)同学们经百度查询,得到以下两种解释,你认为下列解释正确的是
A.因为铁表面上有黑色的铁的氧化物,所以叫黑色金属.
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属.
(2)已知某黑色粉末为铁和四氧化三铁的混合物.请定性证明其中含有Fe3O4(只要求简述实验方法)?
(3)将适量FeO粉末溶于过量稀硫酸中,并将所得溶液分为两份.一份溶液加入少量硝酸钾晶体,发现溶液颜色发生改变,此反应的离子方程式为
问题2:已知CuO在高温时可分解为Cu2O和O2,为探究Fe2O3高温灼烧时是否分解为FeO和O2,同学们设想了两种探究方法:
C.看灼烧前后固体颜色是否变化. D.看灼烧前后固体质量改变情况.
(4)实验时应将Fe2O3放在
(5)方法C中,如果高温灼烧后固体颜色发生明显改变,说明Fe2O3发生了变化.能否说明产物一定为FeO?
(6)方法D中,测得实验结果是固体灼烧前后的质量比为30:29,则高温灼烧后固体生成物是
从分类角度看,金属可分为黑色金属和有色金属.铁是日常生活中最常见的黑色金属,请回答下列问题:
问题1:铁为何称为黑色金属?
(1)同学们经百度查询,得到以下两种解释,你认为下列解释正确的是______.(填字母)
A.因为铁表面上有黑色的铁的氧化物,所以叫黑色金属.
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属.
(2)已知某黑色粉末为铁和四氧化三铁的混合物.请定性证明其中含有Fe3O4(只要求简述实验方法)?______.
(3)将适量FeO粉末溶于过量稀硫酸中,并将所得溶液分为两份.一份溶液加入少量硝酸钾晶体,发现溶液颜色发生改变,此反应的离子方程式为______,另一份溶液加入一定量氢氧化钠溶液,所见主要实验现象为______.
问题2:已知CuO在高温时可分解为Cu2O和O2,为探究Fe2O3高温灼烧时是否分解为FeO和O2,同学们设想了两种探究方法:
C.看灼烧前后固体颜色是否变化. D.看灼烧前后固体质量改变情况.
(4)实验时应将Fe2O3放在______中灼烧.(填仪器名称)
(5)方法C中,如果高温灼烧后固体颜色发生明显改变,说明Fe2O3发生了变化.能否说明产物一定为FeO?______,(填“能”或“不能”)理由是______.
(6)方法D中,测得实验结果是固体灼烧前后的质量比为30:29,则高温灼烧后固体生成物是______.
查看习题详情和答案>>
问题1:铁为何称为黑色金属?
(1)同学们经百度查询,得到以下两种解释,你认为下列解释正确的是______.(填字母)
A.因为铁表面上有黑色的铁的氧化物,所以叫黑色金属.
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属.
(2)已知某黑色粉末为铁和四氧化三铁的混合物.请定性证明其中含有Fe3O4(只要求简述实验方法)?______.
(3)将适量FeO粉末溶于过量稀硫酸中,并将所得溶液分为两份.一份溶液加入少量硝酸钾晶体,发现溶液颜色发生改变,此反应的离子方程式为______,另一份溶液加入一定量氢氧化钠溶液,所见主要实验现象为______.
问题2:已知CuO在高温时可分解为Cu2O和O2,为探究Fe2O3高温灼烧时是否分解为FeO和O2,同学们设想了两种探究方法:
C.看灼烧前后固体颜色是否变化. D.看灼烧前后固体质量改变情况.
(4)实验时应将Fe2O3放在______中灼烧.(填仪器名称)
(5)方法C中,如果高温灼烧后固体颜色发生明显改变,说明Fe2O3发生了变化.能否说明产物一定为FeO?______,(填“能”或“不能”)理由是______.
(6)方法D中,测得实验结果是固体灼烧前后的质量比为30:29,则高温灼烧后固体生成物是______.
问题1:铁为何称为黑色金属?
(1)同学们经百度查询,得到以下两种解释,你认为下列解释正确的是 .(填字母)
A.因为铁表面上有黑色的铁的氧化物,所以叫黑色金属.
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属.
(2)已知某黑色粉末为铁和四氧化三铁的混合物.请定性证明其中含有Fe3O4(只要求简述实验方法)? .
(3)将适量FeO粉末溶于过量稀硫酸中,并将所得溶液分为两份.一份溶液加入少量硝酸钾晶体,发现溶液颜色发生改变,此反应的离子方程式为 ,另一份溶液加入一定量氢氧化钠溶液,所见主要实验现象为 .
问题2:已知CuO在高温时可分解为Cu2O和O2,为探究Fe2O3高温灼烧时是否分解为FeO和O2,同学们设想了两种探究方法:
C.看灼烧前后固体颜色是否变化. D.看灼烧前后固体质量改变情况.
(4)实验时应将Fe2O3放在 中灼烧.(填仪器名称)
(5)方法C中,如果高温灼烧后固体颜色发生明显改变,说明Fe2O3发生了变化.能否说明产物一定为FeO? ,(填“能”或“不能”)理由是 .
(6)方法D中,测得实验结果是固体灼烧前后的质量比为30:29,则高温灼烧后固体生成物是 . 查看习题详情和答案>>
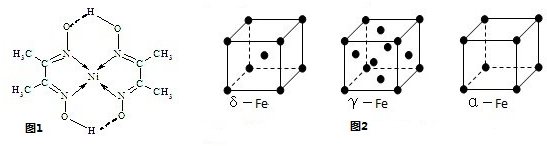
Ni、Fe是重要的金属,它们的单质及化合物在科学研究和工业生产中具有许多用途.
(1)基态Ni原子电子排布式为
(2)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
(3)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
CO与N2结构相似,CO分子内σ键与π键个数之比为
(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO
(5)铁有δ、γ、α三种同素异形体(图2),γ、α两种晶胞中铁原子的配位数之比为
| 3 |
| ||
| 3 |
| ||