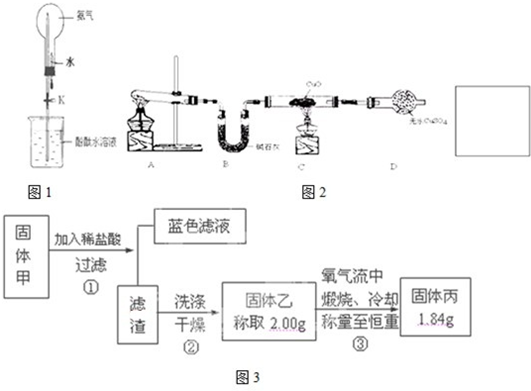
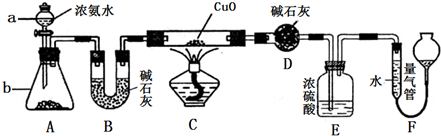
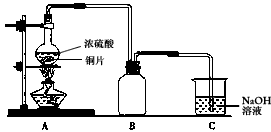
摘要:c.Cu2O能溶于氨水生成无色的[Cu(NH3)2]+.[Cu((NH3)2+在氨水中被空气中的氧气氧化成深蓝色的[Cu(NH3)4]2+.回答下列问题: (1)实验结束后.装置C中的溶液中可能含有的溶质有 . (2)第②步操作要注意的问题是 ,对比①②两步操作中的现象.你能得到的结论是 . (3)第③步操作中出现的沉淀是 .请解释出现这一现象的原因 . (4)写出④步涉及的离子方程式 . (5)综合分析铜与浓硫酸的反应.生成的不溶物是 . (6)某工厂拟用废铜屑制备硫酸铜.请你分析利用上述实验原理是否可行.若可行.请说明理由 .若不可行.请设计更合理的实验方案 .
网址:http://m.1010jiajiao.com/timu_id_216037[举报]
1-5AAAAC 6-10BBC AD AD 11-15CB AD CD 16-20 ABABCA 21-25 ACCBA 26-28CCD
29.8分
(1) 碳(或C) (2分)
(2) 
(3) 35.5
30、(12分)(1)(2分)N≡N; 三角锥(错字不给分)
(2)(6分)  略; H2O2+SO2=H2SO4; 4OH――4e―=O2+
2H2O
略; H2O2+SO2=H2SO4; 4OH――4e―=O2+
2H2O
(3)(2分)水迅速冲入试管的,收集的是氨气;水面缓慢上升的,收集的是SO2;
(4)(2分)c(OH―)< c(NH4+)< c(SO42―)< c(H+)
31、14分(1)Na2SO3、NaOH、Na2SO4(2分)
(2)必须在密闭系统中(或在通风厨中)进行,防止污染空气(或防止中毒)(1分);黑色沉淀中有还原性物质,浓硝酸的氧化性强于浓硫酸。(2分)
(3)硫(或S)(1分),硫微溶于酒精但不溶于水,将硫的酒精溶液倒入水中,即可析出固体硫(1分)
(4)Cu2O+4NH3?H2O=2[Cu(NH3)、2]++2OH―+3H2O(2分)
4[Cu(NH3)2]++8NH3?H2O+O2=4[Cu(NH3)4]2++4OH―+6H2O(2分)
 Al2O3+3H2O (2分)
Al2O3+3H2O (2分) 3S+2H2O
(2分)
3S+2H2O
(2分)