网址:http://m.1010jiajiao.com/timu_id_215975[举报]
1 D 2 B
21.(13分)
(1)C
(2) SO2 C + 2
H2SO4(浓)  CO2↑
+ 2 SO2↑+ 2 H2O(3) BCD
CO2↑
+ 2 SO2↑+ 2 H2O(3) BCD
(4)品红褪色,漂白;SO2 + H2O
 H2SO3 (5)不能, 品红溶液、酸性高锰酸钾溶液(答案只要正确就可得分)
H2SO3 (5)不能, 品红溶液、酸性高锰酸钾溶液(答案只要正确就可得分)
22.(13分)(2) 乙
选用试剂
实验现象
第一种方法
C
有机层无色
第二种方法
D
溶液变红
(3)①不可行,因为Br2和Fe3+都能把I― 氧化成I2
 23.(9分))(1)
(2分))
23.(9分))(1)
(2分))

(2) ① (3分))
②NH4Cl、Ca(OH)2 (2分))
③NH3?H2O NH4++OH-(2分))
NH4++OH-(2分))
24.(5分)3Cu +8H+ + 2NO3- =3Cu2+ +2NO↑+4H2O(3分))、0.12mol?L-1(2分))
(1)E的离子结构示意图为


(2)钠、A和D三种元素组成化合物的电子式
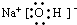
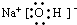
(3)A、D两种元素组成的含有18电子的分子甲常温下甲是一种无色液体.甲的水溶液呈现弱酸性,写出其电离方程式:
 H++HO2ˉ
H++HO2ˉ H++HO2ˉ
H++HO2ˉ(4)A、C以1:2组成的共价分子乙也含有18电子,在碱性溶液中能够将CuO还原为Cu2O,已知每1mol乙参加反应有 4mol电子转移,该反应的化学方程式为:
(5)处理含BD、ED2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质E.已知反应生成1g E固体单质时放出8.4kJ热量,此反应的热化学方程式为
(6)将0.500mol ED2(g)和0.300mol D2(g)放入容积为10L的密闭容器中,反应:D2(g)+2ED2(g)?2ED3(g)在一定条件下达到平衡.①写出反应的平衡常数表达式K=
| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
(1)A—E的元素符号为___________、___________、___________、___________、___________。
(2)C位于元素周期表中第___________周期、第___________族,其阳离子的结构示意图为___________。
(3)D原子的电子式为___________;E离子的符号为___________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由2种元素组成) ___________、___________、___________、___________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式为______________________;
反应中___________为氧化剂,___________为还原剂。
(6)
(1)A—E的元素符号为___________、___________、___________、___________、___________。
(2)C位于元素周期表中第___________周期、第___________族,其阳离子的结构示意图为___________。
(3)D原子的电子式为___________;E离子的符号为___________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由2种元素组成) ___________、___________、___________、___________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式为______________________;
反应中___________为氧化剂,___________为还原剂。
(6)

(1)画出f元素的原子结构示意图_____________。在a、c、d三种元素形成的化合物中存在的化学键类型是_____________。
(2)写出d、e两元素的最高价氧化物的水化物之间反应的离子方程式________________。
(3)a、b、c三种元素的原子按照原子个数4∶1∶1组成化合物M,已知:
M(l)+O2(g)====CO(g)+2H2O(g) ΔH1=-443.6 kJ·mol-1
2CO (g)+O2(g)====2CO2(g) ΔH2=-566.0 kJ·mol-1
试写出M(l)完全燃烧〔生成H2O(g)〕的热化学方程式:______________________________。
(4)以M溶液、氧气为基本反应物的新型燃料电池已经问世,其结构如上图所示(甲醇电离出的H+,可以通过质子交换膜进入另一极)。请写出甲醇在电极上反应的方程式:________________________________,当有
(5)某同学以M燃料电池为电源,均以石墨为电极电解CuSO4溶液,则与电池正极相连的电解池电极上反应的方程式为____________________________________________________。
查看习题详情和答案>>