摘要:29.(1)3 SiO2 6 2 1 6(2)K = C6(CO)/C2(N2) , DH 小于 ,将 增大 .
网址:http://m.1010jiajiao.com/timu_id_215295[举报]
(2009?丹东模拟)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si.

有关氢氧化物沉淀的pH见下表:
请回答下列问题:
(1)滤液A中含有的阳离子有
(2)操作②中涉及的化学方程式为
操作④中生成沉淀G的离子方程式为
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)
a.NaOH溶液 b.氨水 c.MgO d.Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:

流程中由MgCl2冶炼Mg的方法是
查看习题详情和答案>>

有关氢氧化物沉淀的pH见下表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有
Fe3+、Al3+、Mg2+、H+
Fe3+、Al3+、Mg2+、H+
.(2)操作②中涉及的化学方程式为
2C+SiO2
Si+2CO↑
| ||
2C+SiO2
Si+2CO↑
,
| ||
操作④中生成沉淀G的离子方程式为
AlO-2+CO2+2H2O═Al(OH)3↓+HCO-3
AlO-2+CO2+2H2O═Al(OH)3↓+HCO-3
.(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)
cd
cd
.a.NaOH溶液 b.氨水 c.MgO d.Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:

流程中由MgCl2冶炼Mg的方法是
电解
电解
.在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是防止Mg2+水解,并带走水分
防止Mg2+水解,并带走水分
.红矾钠(重铬酸钠:Na2Cr2O7?2H2O)是重要的基础化工原料.铬常见价态有+3、+6价.铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如图1所示:
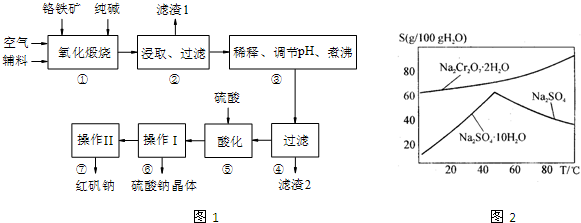
①中主要反应:4FeCr2O4+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2
①中副反应:Al2O3+Na2CO3
2NaAlO2+CO2↑,SiO2+Na2CO3
Na2SiO3+CO2↑
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式 .步骤“①”的反应器材质应选用 (填“瓷质”、“铁质”或“石英质”).
(2)“②”中滤渣1的成分是 ,“③”中调pH值是 (填“调高”或“调低”),“④”中 滤渣2的成分是 .
(3)“⑤”酸化的目的是使CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: .
(4)如图2所示是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线,则操作Ⅰ是 ,操作Ⅱ是 (填序号).
①蒸发浓缩,趁热过滤
②降温结晶,过滤
(5)已知某铬铁矿含铬元素34%,进行步骤①~④中损失2%,步骤⑤~⑦中产率为92%,则1吨该矿石理论上可生产红矾钠 吨(保留2位小数).
查看习题详情和答案>>

①中主要反应:4FeCr2O4+8Na2CO3+7O2
| 高温 |
①中副反应:Al2O3+Na2CO3
| 高温 |
| 高温 |
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式
(2)“②”中滤渣1的成分是
(3)“⑤”酸化的目的是使CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(4)如图2所示是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线,则操作Ⅰ是
①蒸发浓缩,趁热过滤
②降温结晶,过滤
(5)已知某铬铁矿含铬元素34%,进行步骤①~④中损失2%,步骤⑤~⑦中产率为92%,则1吨该矿石理论上可生产红矾钠
(2013?北京)用含有Al2O3、SiO2和少量FeO?xFe2O3的铝灰制备Al2(SO4)3?18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是
(2)将MnO4-氧化Fe2+的离子方程式补充完整:

(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol?L-1
根据表中数据解释步骤Ⅱ的目的:
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是
②Ⅳ中加入MnSO4的目的是
查看习题详情和答案>>
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是
Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
.(2)将MnO4-氧化Fe2+的离子方程式补充完整:

(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:
pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
.(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是
生成黄绿色气体
生成黄绿色气体
.②Ⅳ中加入MnSO4的目的是
除去过量的MnO4-
除去过量的MnO4-
.聚合氯化铝是一种用途广泛的生活和工业污水处理剂,其单体是[Al2(OH)nCl6-n](1≤n≤6)(碱式氯化铝,商品名“BAC”).以下是实验室用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料获得碱式氯化铝的主要实验步骤.
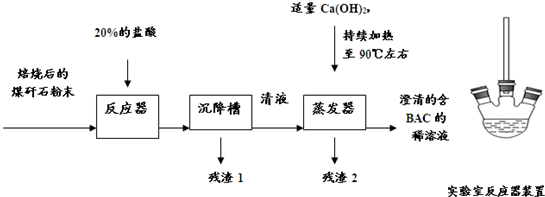
试回答下列问题:
(1)向蒸发器中加入适量Ca(OH)2主要目的是
(2)持续加热并保持90℃左右是为了
(3)残渣2的主要成分可能是
(4)实验中不断用精密pH试纸在反应器上方的排气管口检测,测得pH的变化趋势为
(5)为了定量测定所得的含BAC稀溶液中BAC的含量,你建议可以测量的项目有
查看习题详情和答案>>

试回答下列问题:
(1)向蒸发器中加入适量Ca(OH)2主要目的是
调节溶液的溶液的pH
调节溶液的溶液的pH
.(2)持续加热并保持90℃左右是为了
促进铝盐的水解
促进铝盐的水解
.你建议的加热方式为水浴加热
水浴加热
.(3)残渣2的主要成分可能是
Fe(OH)3
Fe(OH)3
,请另用实验来证明你的结论(填操作与现象)取少许残渣2于小试管中,加适量盐酸溶解,滴加KSCN溶液,溶液呈红色
取少许残渣2于小试管中,加适量盐酸溶解,滴加KSCN溶液,溶液呈红色
.(4)实验中不断用精密pH试纸在反应器上方的排气管口检测,测得pH的变化趋势为
由小到大至基本恒定
由小到大至基本恒定
.(填“由小到大至基本恒定”、“由大到小至基本恒定”或“一直保持恒定”)(5)为了定量测定所得的含BAC稀溶液中BAC的含量,你建议可以测量的项目有
测定碱式氯化铝中铝元素的含量
测定碱式氯化铝中铝元素的含量
. (2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
(2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
| Mg(OH)2 | 8.0 | 12.4 |
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
.(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
.(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:
4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓
4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓
.(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为
2.8
2.8
≤pH<3.0
3.0
.(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示):
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.