题目内容
红矾钠(重铬酸钠:Na2Cr2O7?2H2O)是重要的基础化工原料.铬常见价态有+3、+6价.铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如图1所示:
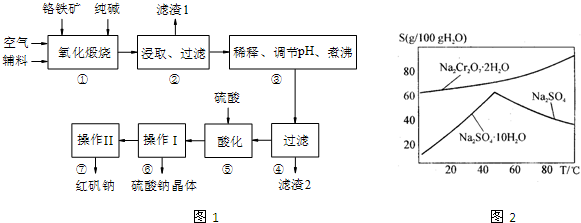
①中主要反应:4FeCr2O4+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2
①中副反应:Al2O3+Na2CO3
2NaAlO2+CO2↑,SiO2+Na2CO3
Na2SiO3+CO2↑
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式 .步骤“①”的反应器材质应选用 (填“瓷质”、“铁质”或“石英质”).
(2)“②”中滤渣1的成分是 ,“③”中调pH值是 (填“调高”或“调低”),“④”中 滤渣2的成分是 .
(3)“⑤”酸化的目的是使CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: .
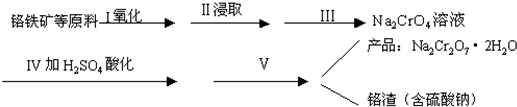
(4)如图2所示是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线,则操作Ⅰ是 ,操作Ⅱ是 (填序号).
①蒸发浓缩,趁热过滤
②降温结晶,过滤
(5)已知某铬铁矿含铬元素34%,进行步骤①~④中损失2%,步骤⑤~⑦中产率为92%,则1吨该矿石理论上可生产红矾钠 吨(保留2位小数).

①中主要反应:4FeCr2O4+8Na2CO3+7O2
| 高温 |
①中副反应:Al2O3+Na2CO3
| 高温 |
| 高温 |
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式
(2)“②”中滤渣1的成分是
(3)“⑤”酸化的目的是使CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(4)如图2所示是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线,则操作Ⅰ是
①蒸发浓缩,趁热过滤
②降温结晶,过滤
(5)已知某铬铁矿含铬元素34%,进行步骤①~④中损失2%,步骤⑤~⑦中产率为92%,则1吨该矿石理论上可生产红矾钠
分析:(1)根据金属元素的化合价书写相应的氧化物,注意氧化物形式中Fe与Cr原子之比为1:2;
“瓷质”或“石英质”仪器都含有二氧化硅,高温下与碳酸钠反应,故性质“铁质”仪器;
(2)步骤①中有氧化铁生成,氧化铝、二氧化硅发生反应生成可溶性盐,氧化镁不反应,据此判断步骤②中滤渣1的成分;
氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁及氧化镁,副反应中生成Na2SiO3、NaAlO2等杂质,将pH值调低,可生成H2SiO3、Al(OH)3沉淀过滤除去;
步骤“③”调节pH值,生成H2SiO3、Al(OH)3沉淀过滤除去,故“④”中滤渣2的成分是H2SiO3、Al(OH)3沉淀;
(3)酸化的目的是使CrO42-转化为Cr2O72-,则CrO42-在酸性条件下与H+离子反应生成Cr2O72-;
(4)操作Ⅰ是分离出硫酸钠,操作Ⅱ获得红矾钠,由图2可知,硫酸钠的溶解度受温度影响比较大,应采取降温结晶、过滤;红矾钠溶解度受温度影响变化不大,应采取蒸发结晶、过滤;
(5)令生成红矾钠x吨,根据关系式 2Cr~Na2Cr2O7?2H2O进行计算,注意各步的损失率、利用率.
“瓷质”或“石英质”仪器都含有二氧化硅,高温下与碳酸钠反应,故性质“铁质”仪器;
(2)步骤①中有氧化铁生成,氧化铝、二氧化硅发生反应生成可溶性盐,氧化镁不反应,据此判断步骤②中滤渣1的成分;
氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁及氧化镁,副反应中生成Na2SiO3、NaAlO2等杂质,将pH值调低,可生成H2SiO3、Al(OH)3沉淀过滤除去;
步骤“③”调节pH值,生成H2SiO3、Al(OH)3沉淀过滤除去,故“④”中滤渣2的成分是H2SiO3、Al(OH)3沉淀;
(3)酸化的目的是使CrO42-转化为Cr2O72-,则CrO42-在酸性条件下与H+离子反应生成Cr2O72-;
(4)操作Ⅰ是分离出硫酸钠,操作Ⅱ获得红矾钠,由图2可知,硫酸钠的溶解度受温度影响比较大,应采取降温结晶、过滤;红矾钠溶解度受温度影响变化不大,应采取蒸发结晶、过滤;
(5)令生成红矾钠x吨,根据关系式 2Cr~Na2Cr2O7?2H2O进行计算,注意各步的损失率、利用率.
解答:解:(1)FeCr2O4中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,FeCr2O4中铁铁原子与Cr原子物质的量之比为1:2,所以FeCr2O4写成氧化物形式为FeO?Cr2O3,
“瓷质”或“石英质”仪器都含有二氧化硅,高温下与碳酸钠反应,故选择“铁质”仪器,
故答案为:FeO?Cr2O3 ;铁质;
(2)步骤①中有氧化铁生成,氧化铝、二氧化硅发生反应生成可溶性盐,氧化镁不反应,据此判断步骤②中滤渣1的成分;
氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁及氧化镁,副反应中生成Na2SiO3、NaAlO2等杂质,将pH值调低,可生成H2SiO3、Al(OH)3沉淀过滤除去;
步骤“③”调节pH值,生成H2SiO3、Al(OH)3沉淀过滤除去,故“④”中滤渣2的成分是H2SiO3、Al(OH)3沉淀,
故答案为:Fe2O3、MgO;调低;H2SiO3、Al(OH)3;
(3)酸化的目的是使CrO42-转化为Cr2O72-,则CrO42-在酸性条件下与H+离子反应生成Cr2O72-,该反应为可逆反应,反应的离子方程式为2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(4)操作Ⅰ是分离出硫酸钠,操作Ⅱ获得红矾钠,由图2可知,硫酸钠的溶解度受温度影响比较大,应采取降温结晶、过滤;红矾钠溶解度受温度影响变化不大,应采取蒸发结晶、过滤,
故答案为:②;①;
(5)令生成红矾钠x吨,则:
2Cr~~~~~Na2Cr2O7?2H2O
104 298
1吨×37%×(1-2%)×92% x吨
所以:104:298=1吨×37%×(1-2%)×92%:x吨
解得x=0.88,
故答案为:0.88.
“瓷质”或“石英质”仪器都含有二氧化硅,高温下与碳酸钠反应,故选择“铁质”仪器,
故答案为:FeO?Cr2O3 ;铁质;
(2)步骤①中有氧化铁生成,氧化铝、二氧化硅发生反应生成可溶性盐,氧化镁不反应,据此判断步骤②中滤渣1的成分;
氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁及氧化镁,副反应中生成Na2SiO3、NaAlO2等杂质,将pH值调低,可生成H2SiO3、Al(OH)3沉淀过滤除去;
步骤“③”调节pH值,生成H2SiO3、Al(OH)3沉淀过滤除去,故“④”中滤渣2的成分是H2SiO3、Al(OH)3沉淀,
故答案为:Fe2O3、MgO;调低;H2SiO3、Al(OH)3;
(3)酸化的目的是使CrO42-转化为Cr2O72-,则CrO42-在酸性条件下与H+离子反应生成Cr2O72-,该反应为可逆反应,反应的离子方程式为2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(4)操作Ⅰ是分离出硫酸钠,操作Ⅱ获得红矾钠,由图2可知,硫酸钠的溶解度受温度影响比较大,应采取降温结晶、过滤;红矾钠溶解度受温度影响变化不大,应采取蒸发结晶、过滤,
故答案为:②;①;
(5)令生成红矾钠x吨,则:
2Cr~~~~~Na2Cr2O7?2H2O
104 298
1吨×37%×(1-2%)×92% x吨
所以:104:298=1吨×37%×(1-2%)×92%:x吨
解得x=0.88,
故答案为:0.88.
点评:本题考查化学工艺流程、物质的分离提纯、对操作的理解分析与评价、化学计算等,题目综合性较大,侧重对学生综合能力的考查,理解原理、掌握元素化合物性质是关键.

练习册系列答案
相关题目
 Cr2O72-+H2O
Cr2O72-+H2O
 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。