摘要:答案使Ca2+.Al3+.Fe3+浸出(或使Ca2+.Al3+.Fe3+溶解)(2分.只回答对1个或2个离子.得1分)(2)Ca2++(NH4)2C2O4 = CaC2O4↓+2NH4+3.Al(OH)3Fe3++3SCN―Fe(SCN)3(写成其它正确的络合离子形式给分.2分)(5)使Fe3+转化为Fe(OH)3沉淀,检验Al3+.5(舒城中学2008/2009学年度第四次月考)物质A.D及F的水溶液均呈黄色.D是单质.F的溶液遇苯酚显紫色.A是一种重要工业生产中的主要原料.且A.C.D均含有某一非金属元素.C的相对分子质量与过氧化氢的相对分子质量相等.反应过程中生成的水等与转化无关的物质已经略去.这些物质有以下转化关系.试回答以下问题:
网址:http://m.1010jiajiao.com/timu_id_204462[举报]
(2011?天津模拟)下面实验是用于测定茶叶中含有Ca、Al、Fe三种元素的.
已知:草酸铵(NH4)2C2O4属于弱电解质.草酸钙难溶于水,Ca2+、Al3+、Fe3+完全沉淀分别pH:pH≥13;pH≥5.5;pH≥4.1;

根据上述过程及信息填空.
(1)步骤②加盐酸的作用是
(2)写出检验Ca2+的离子方程式
(3)写出沉淀C所含主要物质的化学式
(4)写出步骤⑧中加入A试剂生成红色溶液的离子方程式
(5)步骤⑨的作用是
查看习题详情和答案>>
已知:草酸铵(NH4)2C2O4属于弱电解质.草酸钙难溶于水,Ca2+、Al3+、Fe3+完全沉淀分别pH:pH≥13;pH≥5.5;pH≥4.1;

根据上述过程及信息填空.
(1)步骤②加盐酸的作用是
使Ca2+、Al3+、Fe3+等离子溶解
使Ca2+、Al3+、Fe3+等离子溶解
(2)写出检验Ca2+的离子方程式
Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+
Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+
(3)写出沉淀C所含主要物质的化学式
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
(4)写出步骤⑧中加入A试剂生成红色溶液的离子方程式
Fe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
(5)步骤⑨的作用是
将Fe3+转化为沉淀,并检验Al元素的存在
将Fe3+转化为沉淀,并检验Al元素的存在
.
某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素.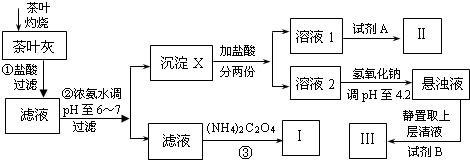
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
(1)步骤①中加入盐酸的作用是 .
(2)步骤②中调节pH至6~7的目的是 .
(3)沉淀X所含主要物质的化学式为 .
(4)写出步骤③中发生反应的离子方程式: .
(5)试剂A为 ;试剂B为铝试剂,加入该试剂后的实验现象是 .
查看习题详情和答案>>

已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
(2)步骤②中调节pH至6~7的目的是
(3)沉淀X所含主要物质的化学式为
(4)写出步骤③中发生反应的离子方程式:
(5)试剂A为
茶是我国人民喜爱的饮品.某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素.
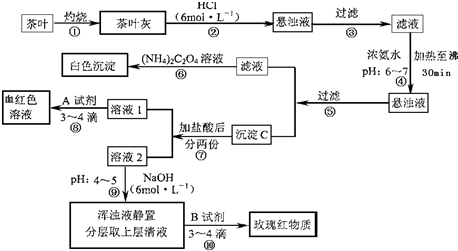
【资料查询】:草酸铵[(NH4)2C2O4]属于弱电解质.草酸钙(CaC2O4)难溶于水.Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1.
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 .
(2)步骤③操作中用到的玻璃仪器有 .
(3)写出步骤⑥中检验Ca2+存在的离子方程式 .
(4)写出沉淀C所含主要物质的化学式 .
(5)写出步骤⑧中选用A试剂的化学式 .
(6)步骤⑨的作用是 ,猜测步骤⑩的目的是 .
查看习题详情和答案>>

【资料查询】:草酸铵[(NH4)2C2O4]属于弱电解质.草酸钙(CaC2O4)难溶于水.Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1.
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是
(2)步骤③操作中用到的玻璃仪器有
(3)写出步骤⑥中检验Ca2+存在的离子方程式
(4)写出沉淀C所含主要物质的化学式
(5)写出步骤⑧中选用A试剂的化学式
(6)步骤⑨的作用是
某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素。

已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
|
|
Ca(OH)2 |
Al(OH)3 |
Fe(OH)3 |
|
pH |
≥13 |
≥5.2 |
≥4.1 |
(1)步骤①中加入盐酸的作用是 。
(2)步骤②中调节pH至6~7的目的是 。
(3)沉淀X所含主要物质的化学式为 。
(4)写出步骤③中发生反应的离子方程式: 。
(5)试剂A为 ;试剂B为铝试剂,加入该试剂后的实验现象是 。
查看习题详情和答案>>
某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素。
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| | Ca(OH)2 | Al(OH)3 | Fe(OH)3 |
| pH | ≥13 | ≥5.2 | ≥4.1 |
(2)步骤②中调节pH至6~7的目的是 。
(3)沉淀X所含主要物质的化学式为 。
(4)写出步骤③中发生反应的离子方程式: 。
(5)试剂A为 ;试剂B为铝试剂,加入该试剂后的实验现象是 。 查看习题详情和答案>>