网址:http://m.1010jiajiao.com/timu_id_204300[举报]
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
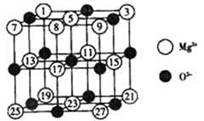
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图
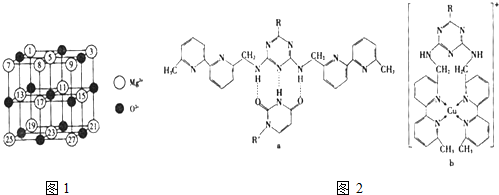
中错误:
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
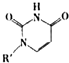 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含
(12分)(1)Cu位于元素周期表第I B族,Cu2+的核外电子排布式为 。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:
下列说法正确的是 (填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(5)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子占有 种能量不同的原子轨道
(6)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③
 、④
、④ 等,其中分子中C原子为SP2杂化的
等,其中分子中C原子为SP2杂化的有 (填物质序号),预测HCHO分子的立体结构为 形。 查看习题详情和答案>>
(12分)(1)Cu位于元素周期表第I B族,Cu2+的核外电子排布式为 。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:

下列说法正确的是 (填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
(5)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子占有 种能量不同的原子轨道
(6)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③ 、④
、④ 等,其中分子中C原子为SP2杂化的
等,其中分子中C原子为SP2杂化的
有 (填物质序号),预测HCHO分子的立体结构为 形。
查看习题详情和答案>>
(1)下列现象和应用与电子跃迁无关的是________。
 A.激光 B.焰色反应 C.燃烧放热
A.激光 B.焰色反应 C.燃烧放热
D.原子光谱 E.霓虹灯 F.石墨导电
(2)已知MgO的晶体结构属于NaCl型。某同学画出的
MgO晶胞结构示意图如下图所示,请改正图中错误:
。(用文字
表述)
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:
。
(4)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
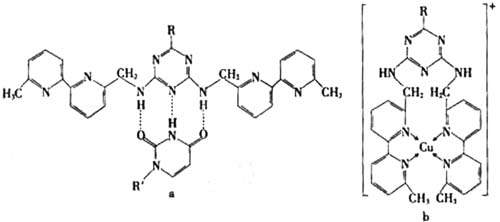
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用),试指出其不同点:
a中含 ,b中含 。(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
查看习题详情和答案>>
(1)下列现象和应用与电子跃迁无关的是________。
 A.激光 B.焰色反应 C.燃烧放热
A.激光 B.焰色反应 C.燃烧放热
D.原子光谱 E.霓虹灯 F.石墨导电
(2)已知MgO的晶体结构属于NaCl型。某同学画出的
MgO晶胞结构示意图如下图所示,请改正图中错误:
。(用文字
表述)
(3)第三周期部分元素氟化物的熔点见下表:
|
氟化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因:
。
(4)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
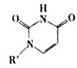 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
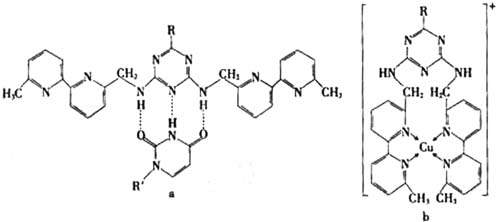
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用),试指出其不同点:
a中含 ,b中含 。(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
查看习题详情和答案>>