网址:http://m.1010jiajiao.com/timu_id_189518[举报]
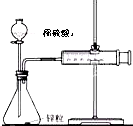 通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:
通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:(1)比较锌粒与不同浓度硫酸反应时的速率,如图装置可通过测定收集等体积H2需要的
(2)在KMnO4与H2C2O4反应中,可通过测定
A.KMnO4溶液中的H+起催化作用
B.生成的CO2逸出,使生成物浓度降低
C. 反应中,生成的Mn2+起催化作用
D.在酸性条件下KMnO4的氧化性增强
(3)在Na2S2O3和H2SO4反应中,该反应速率可通过测定
| 序号 | Na2S2O3溶液 | 稀H2SO4 | 出现混浊时间 | ||
| 浓度 | 用量 | 浓度 | 用量 | ||
| (1) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 10mL | t1 |
| (2) | 0.1mol?L-1 | 10mL+5mL 水 | 0.1mol?L-1 | 10mL | t2 |
| (3) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL+5mL水 | t3 |
| (4) | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 5mL | t4 |
(已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色.)往上述溶液中加入氢氧化钠溶液呈
(1)定性分析:如图1可通过观察
(2)定量分析:如图2所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为
(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.
①写出H2O2在二氧化锰作用下发生反应的化学方程式
| ||
| ||
②实验时放出气体的总体积是
③放出
| 1 |
| 3 |
④反应放出
| 3 |
| 4 |
⑤A、B、C、D各点反应速率快慢的顺序为
⑥解释反应速率变化的原因
⑦计算H2O2的初始物质的量浓度

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为
(3)某同学要利用乙装置测定某H2O2溶液的物质的量浓度.在锥形瓶中加入0.10mol MnO2粉末后加入50mL 该H2O2溶液,在标准状况下放出气体的体积和时间的关系如图2所示.
①写出H2O2在MnO2作用下发生反应的化学方程式
| ||
| ||
②实验中放出气体的总体积是
③A、B、C、D各点反应速率快慢的顺序为
④计算H2O2的初始的物质的量浓度
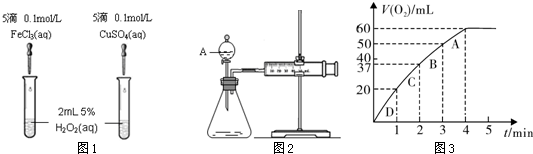
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
丙
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示
① 写出H2O2在MnO2作用下发生反应的化学方程式 。
②计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
查看习题详情和答案>>
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
丙
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示
① 写出H2O2在MnO2作用下发生反应的化学方程式 。
②计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
查看习题详情和答案>>