摘要:Fe 浓H2SO4△ 解析:根据题目所给信息.当苯环上引入Br原子.则其它原子的取代必须发生在Br的邻.对位.若苯环上引入硝基.则其它基团的取代必须发生在硝基的间位.
网址:http://m.1010jiajiao.com/timu_id_186268[举报]
已知A、B、C、D四种分子所含原子的数目依次为1、3、4、6,且都含有18个电子,其中B、C是由两种元素的原子组成,且B分子中两种元素原子的个数比为1:2,C分子中两种元素原子的个数比为1:1,D是一种有毒的有机物.
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);分子空间结构为 形.
(3)C在实验室可用来制取常见的一种气体单质,试写出该化学反应方程式 .
(4)D与水任意比例互溶,原因是(须指明D是何物质): .
(5)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型).
查看习题详情和答案>>
(1)组成A分子的原子的元素符号是
(2)从B分子的立体结构判断,该分子属于
(3)C在实验室可用来制取常见的一种气体单质,试写出该化学反应方程式
(4)D与水任意比例互溶,原因是(须指明D是何物质):
(5)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于
原子序数依次增大的主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1. 回答下列问题:
(1)这四种元素中电负性最大的是
(2)C所在的主族元素气态氢化物中,沸点最低的是
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体 结构如图所示,其原子的杂化类型为
(4)D的水合醋酸盐晶体局部结构如图,该晶体中含有的化学键是
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如图:
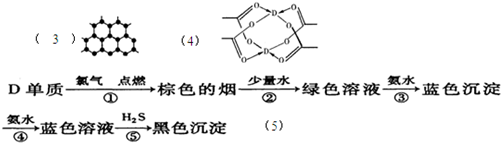
请书写第⑤反应的离子方程式:
查看习题详情和答案>>
(1)这四种元素中电负性最大的是
Cl
Cl
(填元素符号)、第一电离能最小的是Cu
Cu
(填元素符号);(2)C所在的主族元素气态氢化物中,沸点最低的是
HCl
HCl
(填化学式);(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体 结构如图所示,其原子的杂化类型为
sp2
sp2
;(4)D的水合醋酸盐晶体局部结构如图,该晶体中含有的化学键是
①②③
①②③
;①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如图:

请书写第⑤反应的离子方程式:
〔Cu(NH3)4〕2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O
〔Cu(NH3)4〕2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O
.A、B、C、D、E是相邻的三个周期中的五种短周期元素,它们的原子序数依次增大,B、C、D属于同一周期,A、E属于同一主族.已知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C 都能生成气态化合物;③D与E生成离子化合物,其离子的电子层结构相同.回答
(1)A为
(2)D在周期表中属于第
 .
.
(3)B与C可形成BC2的化合物的电子式为:
 ,属于
,属于
(4)C与E反应条件不同产物不同,请写出不同条件下不同产物的对应化学方程式①
查看习题详情和答案>>
(1)A为
H
H
(填元素符号,下同); C为O
O
;(2)D在周期表中属于第
二
二
周期,第VIIA
第VIIA
族元素,其原子结构示意图为

(3)B与C可形成BC2的化合物的电子式为:


共价
共价
化合物(填共价或离子)(4)C与E反应条件不同产物不同,请写出不同条件下不同产物的对应化学方程式①
4Na+O2=2Na2O
4Na+O2=2Na2O
;②2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
.
| ||
物质A~X有如图所示的转化关系(部分反应物、生成物及反应条件没有列出).其中B、C、D为常见单质,C为气体,B、D为金属.常温下K为气体,且能使品红溶液褪色.将E的饱和溶液滴入沸水可制得一种红褐色胶体;J为红棕色固体,F为常见的强酸.
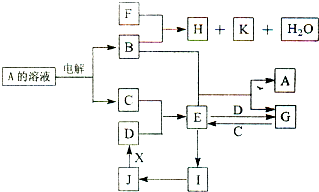
请回答下列问题:
(1)组成C的元素在周期表的位置是 ;B与F反应的化学方程式为 .
(2)实现J→D的变化:若X是非金属固体单质,则X是 (填化学式);若X是常见金属单质,请写出此反应的化学方程式: .
(3)含杂质的D在潮湿的空气中易发生吸氧腐蚀,其正极的电极反应式为 .
(4)室温时,若A的溶液pH=5,则溶液中水电离的c(H+)= mol/L,若用惰性电极电解析出3.2g B,则反应中转移电子的物质的量为 mol.
查看习题详情和答案>>

请回答下列问题:
(1)组成C的元素在周期表的位置是
(2)实现J→D的变化:若X是非金属固体单质,则X是
(3)含杂质的D在潮湿的空气中易发生吸氧腐蚀,其正极的电极反应式为
(4)室温时,若A的溶液pH=5,则溶液中水电离的c(H+)=
(2011?昌平区二模)A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素.又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题:
(1)D在元素周期表中的位置是
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为
 .
.
(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为
(4)写出实验室制备BA3的化学方程式
(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是
查看习题详情和答案>>
(1)D在元素周期表中的位置是
第三周期第ⅠA族
第三周期第ⅠA族
.(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为


(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;若有1mol电子转移,生成Z的物质的量为0.5
0.5
mol.(4)写出实验室制备BA3的化学方程式
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.将BA3通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式
| ||
8NH3+3Br2=N2+6NH4++6Br-
8NH3+3Br2=N2+6NH4++6Br-
.(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是
N2H4+4OH--4e-═N2+4H2O
N2H4+4OH--4e-═N2+4H2O
.以石墨为电极,用该电池电解100mL饱和食盐水,一段时间后,在两极共收集到224mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)13
13
.