题目内容
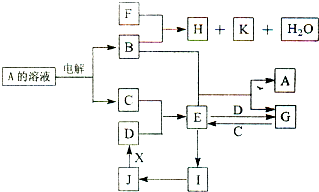
物质A~X有如图所示的转化关系(部分反应物、生成物及反应条件没有列出).其中B、C、D为常见单质,C为气体,B、D为金属.常温下K为气体,且能使品红溶液褪色.将E的饱和溶液滴入沸水可制得一种红褐色胶体;J为红棕色固体,F为常见的强酸.
请回答下列问题:
(1)组成C的元素在周期表的位置是 ;B与F反应的化学方程式为 .
(2)实现J→D的变化:若X是非金属固体单质,则X是 (填化学式);若X是常见金属单质,请写出此反应的化学方程式: .
(3)含杂质的D在潮湿的空气中易发生吸氧腐蚀,其正极的电极反应式为 .
(4)室温时,若A的溶液pH=5,则溶液中水电离的c(H+)= mol/L,若用惰性电极电解析出3.2g B,则反应中转移电子的物质的量为 mol.

请回答下列问题:
(1)组成C的元素在周期表的位置是
(2)实现J→D的变化:若X是非金属固体单质,则X是
(3)含杂质的D在潮湿的空气中易发生吸氧腐蚀,其正极的电极反应式为
(4)室温时,若A的溶液pH=5,则溶液中水电离的c(H+)=
分析:K常温下为气体,能使品红溶液褪色,应为SO2,将E溶液滴入沸水可制得一种红褐色胶体,则可E为FeCl3,则C为Cl2,D为Fe,则G为FeCl2,由此可知B为Cu,A为CuCl2,
J为红棕色固体,应为Fe2O3,则I为Fe(OH)3,则F应为H2SO4,H为CuSO4,结合对应物质的性质以及题目要求解答该题.
J为红棕色固体,应为Fe2O3,则I为Fe(OH)3,则F应为H2SO4,H为CuSO4,结合对应物质的性质以及题目要求解答该题.
解答:解:K常温下为气体,能使品红溶液褪色,应为SO2,将E溶液滴入沸水可制得一种红褐色胶体,则可E为FeCl3,则C为Cl2,D为Fe,则G为FeCl2,由此可知B为Cu,A为CuCl2,J为红棕色固体,应为Fe2O3,则I为Fe(OH)3,则F应为H2SO4,H为CuSO4,
(1)组成C的元素为Cl,位于元素周期表中第三周期第ⅤⅡA族,B与F反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:第三周期第ⅤⅡA族;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(2)为实现J→D的变化,若X是非金属固体单质,则X可能是C,若X是金属单质,应为Al,发生铝热反应,方程式为2Al+Fe2O3
2Fe+Al2O3,
故答案为:C;2Al+Fe2O3
2Fe+Al2O3;
(3)含杂质的D在潮湿的空气中易发生吸氧腐蚀,负极上Fe失去电子,正极上氧气得到电子,正极反应为2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
(4)A为CuCl2,促进水的电离,则pH=5,则溶液中水电离的c(H+)=1×10-5mol/L,用惰性电极电解析出3.2g B,由CuCl2
Cu+Cl2↑~2e-,则转移的电子为
×2=0.1mol,故答案为:1×10-5;0.1.
(1)组成C的元素为Cl,位于元素周期表中第三周期第ⅤⅡA族,B与F反应的化学方程式为Cu+2H2SO4(浓)
| ||
故答案为:第三周期第ⅤⅡA族;Cu+2H2SO4(浓)
| ||
(2)为实现J→D的变化,若X是非金属固体单质,则X可能是C,若X是金属单质,应为Al,发生铝热反应,方程式为2Al+Fe2O3
| ||
故答案为:C;2Al+Fe2O3
| ||
(3)含杂质的D在潮湿的空气中易发生吸氧腐蚀,负极上Fe失去电子,正极上氧气得到电子,正极反应为2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
(4)A为CuCl2,促进水的电离,则pH=5,则溶液中水电离的c(H+)=1×10-5mol/L,用惰性电极电解析出3.2g B,由CuCl2
| ||
| 3.2g |
| 64g/mol |
点评:本题考查无机物的推断,题目难度中等,注意根据相关物质的颜色以及转化关系作为该题的突破口,综合考查元素化合物与化学反应原理,把握物质的性质及原电池原理、电解原理即可解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2011?咸阳模拟)A、D、E、G四种单质和X、Y、Z三种化合物均是中学化学中的重要物质,他们之间有如图所示的转化关系.常温常压下,X是无色无味的液体,Y是黑色晶体,Z的水溶液是一种弱酸,反应(1)不能在玻璃仪器中进行.请回答下列问题:
(2011?咸阳模拟)A、D、E、G四种单质和X、Y、Z三种化合物均是中学化学中的重要物质,他们之间有如图所示的转化关系.常温常压下,X是无色无味的液体,Y是黑色晶体,Z的水溶液是一种弱酸,反应(1)不能在玻璃仪器中进行.请回答下列问题:



