网址:http://m.1010jiajiao.com/timu_id_181877[举报]
1
2
3
4
5
6
7
8
9
10
C
B
D
D
A
C
C
B
D
C
11
12
13
14
15
16
17
18
19
20
CD
BD
AD
CD
AD
D
B
AC
B
C
21.(1).AD (2). HCOOC2H5, CH3OH,CH3COOH、HCOOH (每空各2分)
 22.(1). C6H5O- +
H2O + CO
22.(1). C6H5O- +
H2O + CO
 (2). 氨水 AgNO3 (每空各1分)
(2). 氨水 AgNO3 (每空各1分)
CH2(OH)(CHOH)4CHO + 2[Ag(NH3)2]OH CH2(OH)(CHOH)4COONH4 + 2Ag + 3NH3 + H2O 防倒吸 (每空各2分)
23.(1).略 (2).略 (3).3,3,4-三甲基已烷 (4).C10H18O (每空各2分)
24.(1). n(C): n(H): n(O)= 2:6:1 (2).C2H6O
(3).CH3CH2OH CH3OCH3 (4).CH3CH2OH
 (5).CH2=CH2 + HCl
CH3CH2 Cl (方程式各2分,其余每空各1分)
(5).CH2=CH2 + HCl
CH3CH2 Cl (方程式各2分,其余每空各1分)
 25.(1).B
(2).1:1
25.(1).B
(2).1:1
(3). CH2=CH2 + O2 →
 |
(4). +2 CH3COOH + 2 H2O
(每空各2分)
26.⑴.NaOH溶液、△ 浓硫酸 、△
⑵.A: F:
F: 
⑶.2 +O2
+O2 2
2  +2H2O
+2H2O
(4).②⑥ (每空各2分)
 27.
27.
28.⑴.M=

请回答:
(1)装置A中反应的化学方程式是
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是
(3)装置B中产生了白色沉淀,其成分是
(4)甲乙两同学分析B中产生白色沉淀的原因:
甲同学:在酸性条件下SO2与Fe3+反应;
乙同学:在酸性条件下SO2与NO3-反应;
①按甲同学观点,装置B中反应的离子方程式是
②按乙同学观点,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验.应选择的试剂是(填序号)
a.0.1mol?L-1稀硝酸
b.15mol?L-1Fe(NO3)2溶液
C.6.0mol?L-1NaNO3和0.2mol?L-1盐酸等体积混合的溶液.
某研究小组用下列装置探究SO2与酸性Fe(NO3)3溶液的反应.
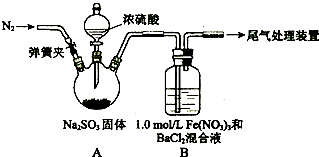
请回答:
(1)装置A中反应的化学方程式是______.
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______.
(3)装置B中产生了白色沉淀,其成分是______,说明SO2具有______性.
(4)甲乙两同学分析B中产生白色沉淀的原因:
甲同学:在酸性条件下SO2与Fe3+反应;
乙同学:在酸性条件下SO2与NO3-反应;
①按甲同学观点,装置B中反应的离子方程式是______,证明该观点应进一步确认生成的新物质,其实验操作及现象是______.
②按乙同学观点,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验.应选择的试剂是(填序号)______.
a.0.1mol?L-1稀硝酸
b.15mol?L-1Fe(NO3)2溶液
C.6.0mol?L-1NaNO3和0.2mol?L-1盐酸等体积混合的溶液.
查看习题详情和答案>>
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
| 通电 |
分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
| 加热 |
①下列各项中,不能说明该反应已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1
③已知甲醇燃料电池的工作原理如图乙所示.
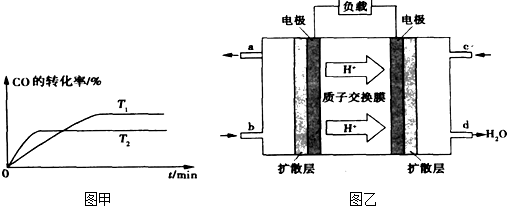
①该电池工作时,b口通入的物质为
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是______
A.40.32L B.30.24L C.20.16L D.6.72L
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?______若不可行,请说明原因.若可行,请写出反应的离子方程式______.
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是______.则反应中所消耗的硝酸的物质的量可能为______
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.则在该反应中,H2O2的作用是______剂,该反应的化学方程式为______.
②乙同学提出,设计一个常见的实验装置,在一定条件下,不需再外加化学试剂,就能将铜溶解在盐酸中.请写出该反应的化学方程式:______,画出相应的装置图并指明电极材料______.
查看习题详情和答案>>
(1)①在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是______
A.40.32L B.30.24L C.20.16L D.6.72L
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?______若不可行,请说明原因.若可行,请写出反应的离子方程式______.
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是______.则反应中所消耗的硝酸的物质的量可能为______
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.则在该反应中,H2O2的作用是______剂,该反应的化学方程式为______.
②乙同学提出,设计一个常见的实验装置,在一定条件下,不需再外加化学试剂,就能将铜溶解在盐酸中.请写出该反应的化学方程式:______ CuCl2+H2↑ 查看习题详情和答案>>