摘要:HCl为强电解质.HAc为弱电解质.滴加NH3?H2O弱电解质先与HCl反应.生成同样为强电解质的NH4Cl.但溶液体积不断增大.溶液稀释.所以电导率下降.
网址:http://m.1010jiajiao.com/timu_id_181594[举报]
(2010?海南模拟)(1)体积相同,浓度均为0.2mol/L的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为
(2)体积相同,pH均等于3的盐酸和CH3COOH溶液,分别加入等浓度的NaHCO3的溶液,开始时放出二氧化碳的速率盐酸
(3)常温下,将pH=2的盐酸和pH=12的氨水等体积混合,混合后溶液的pH
(4)如何证明醋酸是弱酸?
查看习题详情和答案>>
m<n
m<n
,稀释后两溶液中和NaOH溶液的能力相同
相同
.(2)体积相同,pH均等于3的盐酸和CH3COOH溶液,分别加入等浓度的NaHCO3的溶液,开始时放出二氧化碳的速率盐酸
等于
等于
醋酸(填“大于”“等于”“小于”)(3)常温下,将pH=2的盐酸和pH=12的氨水等体积混合,混合后溶液的pH
大于
大于
7(填“大于”“等于”“小于”).并解释你所填选项的理由一水合氨为弱电解质,氨水中还有大量未电离的一水合氨,HCl为强电解质,等体积等pH值的盐酸和氨水混合后,氨水大大过量,故溶液呈碱性,pH值大于7
一水合氨为弱电解质,氨水中还有大量未电离的一水合氨,HCl为强电解质,等体积等pH值的盐酸和氨水混合后,氨水大大过量,故溶液呈碱性,pH值大于7
.(4)如何证明醋酸是弱酸?
测量常温下,0.01mol/L的CH3COOH溶液的pH值,若pH值大于2,则证明醋酸为弱电解质
测量常温下,0.01mol/L的CH3COOH溶液的pH值,若pH值大于2,则证明醋酸为弱电解质
.A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去).
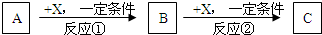
试回答:
(1)若X是强氧化性单质,则A不可能是
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
查看习题详情和答案>>

试回答:
(1)若X是强氧化性单质,则A不可能是
de
de
.a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为
FeCl3
FeCl3
;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)2Fe3++Fe═3Fe2+ 保证溶液中Fe2+为主
2Fe3++Fe═3Fe2+ 保证溶液中Fe2+为主
.检验此C溶液中金属元素价态的操作方法是向溶液中滴加少量KSCN溶液,无明显现象,通入少量Cl2溶液呈血红色
向溶液中滴加少量KSCN溶液,无明显现象,通入少量Cl2溶液呈血红色
.(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
Al(OH)3
Al(OH)3
,X的化学式可能为(写出不同类物质)HCl
HCl
或NaOH
NaOH
.反应①的离子方程式为AlO2-+H++H2O═Al(OH)3↓或Al3++3OH-═Al(OH)3↓
AlO2-+H++H2O═Al(OH)3↓或Al3++3OH-═Al(OH)3↓
.已知酸式盐NaHB在水溶液中存在下列反应:
①NaHB═Na++HB-
②HB-?H++B2-
③HB-+H2O?H2B十OH-,且溶液中c(H+)>c(OH-)
下列说法中一定正确的是( )
①NaHB═Na++HB-
②HB-?H++B2-
③HB-+H2O?H2B十OH-,且溶液中c(H+)>c(OH-)
下列说法中一定正确的是( )
查看习题详情和答案>>
元素周期律和元素周期表对深化物质性质的认识具有重要的作用,有利于将零乱的元素化合物知识整合起来形成知识网络.某同学整理了关于氯元素的相关知识,请你补充完整.
(1)氯元素的原子结构示意图为
 ,在周期表中的位置为
,在周期表中的位置为
(2)氯、硫、磷三种元素对应的气态氢化物中,稳定性由强到弱的顺序为
(3)含有氯元素的常见物质转化关系如图: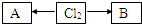 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
查看习题详情和答案>>
(1)氯元素的原子结构示意图为


第三周期、第ⅦA族
第三周期、第ⅦA族
.(2)氯、硫、磷三种元素对应的气态氢化物中,稳定性由强到弱的顺序为
HCl>H2S>PH3
HCl>H2S>PH3
,氯、溴两种元素的单质中,氧化性强的是Cl2
Cl2
,设计简单的实验方案证明取少量NaBr(HBr)溶液,向其中通入氯气,溶液变为橙色,则证明Cl2的氧化性强于Br2
取少量NaBr(HBr)溶液,向其中通入氯气,溶液变为橙色,则证明Cl2的氧化性强于Br2
.(3)含有氯元素的常见物质转化关系如图:
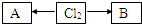 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
| ||
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是
| ||
HClO4
HClO4
(填化学式).下列说法正确的是( )
| A、强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | ||
| B、因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积、等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比中和盐酸消耗的NaOH的量少 | ||
| C、足量Zn分别与等体积、等物质的量浓度的盐酸和醋酸反应时,产生HΡ的量相同,放出H2的速率不同 | ||
D、在物质的量浓度相同的磷酸钠溶液和磷酸溶液中P
|