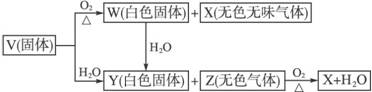
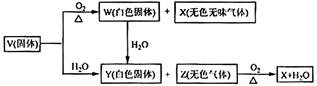
摘要:(1)5种化合物分别是V .W .X .Y .Z ,(2)由上述5中化合物中的某2种化合物反应可生成一种新化合物.它包含了5种化合物中的所有元素.生成该化合物的化学方程式是 ,(3)V的电子式是 .[解析]考查:元素推断与元素及其化合物相结合知识.固体V与水水反应可得Y白色固体与Z无色气体就是本题的“突破口 .固体V可能是碳化钙.过氧化钠.氮化镁.硫化铝等.X是一种无色无味的气体.是由两种元素构成的化合物.且由固体V与氧气反应得到.可知X和W均是氧化物.我们比较熟悉的有CO2.NO.CO等.并可由此确定V中含有碳元素或氮元素等.W和Y均为白色固体.且W与 H2O反应生成Y.又W是氧化物.符合这些条件的物质常见的有氧化钙.氧化镁.氧化钠等.据此可初步推断V为碳化钙.氮化镁一类的物质.题目中又告诉我们:上述5种化合物涉及的所有元素的原子序数之和等于35.可计算推知:V是CaC2.Z是C2H2.[答案](1)CaC2.CaO.CO2.Ca(OH)2.C2H2..2+CO2=Ca(HCO3)2
网址:http://m.1010jiajiao.com/timu_id_180778[举报]
V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成.上述5种化合物涉及的所有元素的原子序数之和等于35.它们之间的反应关系如图:

(1)5种化合物分别是V
(2)由上述5种化合物中的某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是
(3)V的电子式是
 .
.
查看习题详情和答案>>

(1)5种化合物分别是V
CaC2
CaC2
、WCaO
CaO
、XCO2
CO2
、YCa(OH)2
Ca(OH)2
、ZC2H2
C2H2
(填化学式)(2)由上述5种化合物中的某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是
Ca(OH)2+2CO2=Ca(HCO3)2
Ca(OH)2+2CO2=Ca(HCO3)2
;(3)V的电子式是


V、W、X、Y、Z是原子序数依次增大的五种短周期元素,V的原子序数与X的原子序数之和等于Y的原子序数,W的原子序数与X的原子序数之和等于Z的原子序数;V和Y位于同一主族,且Y是一种非金属元素.
(1)比较X、Y、Z的原子半径大小
(2)W与Z形成的单质分别为甲、乙,最简单氢化物分别为丙、丁,下列判断正确的是
a.稳定性:甲>乙,沸点:丙>丁 b.活泼性:甲>乙,沸点:丁>丙
c.稳定性:丙<丁,沸点:甲<乙 d.稳定性:丙>丁,沸点:甲>乙
(3)研究表明:VX2在一定条件下可被还原为晶莹透明的晶体M,其结构中原子的排列为正四面体,请写出M及其2种同素异形体的名称
(4)工业上,将Al2O3、V单质、W单质按物质的量之比1:3:1在高温下反应可制得一种无机非金属材料AlW,该反应的化学方程式为
(5)新型纳米材料ZnFe2Xa可由化合物ZnFe2X4经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
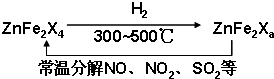
若2mol ZnFe2X a与SO2反应可生成0.75mol S,a=
(6)在t℃时,将a g NH3完全溶于X的常见氢化物,得到V mL溶液,假如该溶液的密度为d g/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述正确的是
A.溶质的质量分数为w=
B.氨水的物质的量浓度为
mol/L
C.溶液中c(OH-)=
mol?L-+c(H+)
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w.
查看习题详情和答案>>
(1)比较X、Y、Z的原子半径大小
Si
Si
>P
P
>O
O
(填写元素符号);(2)W与Z形成的单质分别为甲、乙,最简单氢化物分别为丙、丁,下列判断正确的是
a
a
a.稳定性:甲>乙,沸点:丙>丁 b.活泼性:甲>乙,沸点:丁>丙
c.稳定性:丙<丁,沸点:甲<乙 d.稳定性:丙>丁,沸点:甲>乙
(3)研究表明:VX2在一定条件下可被还原为晶莹透明的晶体M,其结构中原子的排列为正四面体,请写出M及其2种同素异形体的名称
金刚石
金刚石
、足球烯
足球烯
、石墨
石墨
;(4)工业上,将Al2O3、V单质、W单质按物质的量之比1:3:1在高温下反应可制得一种无机非金属材料AlW,该反应的化学方程式为
Al2O3+3C+N2=2AlN+3CO
Al2O3+3C+N2=2AlN+3CO
,当0.2mol W单质参加反应,转移电子数目是1.2NA
1.2NA
(5)新型纳米材料ZnFe2Xa可由化合物ZnFe2X4经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
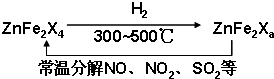
若2mol ZnFe2X a与SO2反应可生成0.75mol S,a=
3.25
3.25
;2molZnFe2Xa可分解物质的量之比为3:2的NO2、NO混合气体(均分解为N2)的体积V=21
21
L(标准状况)(6)在t℃时,将a g NH3完全溶于X的常见氢化物,得到V mL溶液,假如该溶液的密度为d g/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述正确的是
C
C
A.溶质的质量分数为w=
| a |
| Vd-a |
B.氨水的物质的量浓度为
| 1000a |
| 35V |
C.溶液中c(OH-)=
| 1000b |
| V |
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w.
V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如图1所示: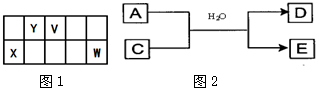
V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝.Z是人体血红蛋白中存在的金属元素.请填写下列空白:
(1)W的原子结构示意图为
 ;
;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应只生成两种化合物,这两种化合物均由两种元素组成.其反应的化学方式
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如图2的反应关系:若E为白色沉淀,则E物质的化学式为
(4)含同价态X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素分别沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则ksp〔X(OH)n〕
(5)联氨(N2H4)也叫做肼,是重要的火箭燃料.以次氯酸钠溶液氧化M,能获得肼的稀溶液.其反应的离子方程式为
查看习题详情和答案>>

V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝.Z是人体血红蛋白中存在的金属元素.请填写下列空白:
(1)W的原子结构示意图为


(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应只生成两种化合物,这两种化合物均由两种元素组成.其反应的化学方式
4Al+3TiO2+3C
2Al2O3+3TiC
| ||
4Al+3TiO2+3C
2Al2O3+3TiC
;
| ||
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如图2的反应关系:若E为白色沉淀,则E物质的化学式为
Al(OH)3
Al(OH)3
;(4)含同价态X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素分别沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则ksp〔X(OH)n〕
>
>
(填“>”或“<”)ksp〔Z(OH)n〕;(5)联氨(N2H4)也叫做肼,是重要的火箭燃料.以次氯酸钠溶液氧化M,能获得肼的稀溶液.其反应的离子方程式为
ClO-+2NH3=N2H4+Cl-+H2O
ClO-+2NH3=N2H4+Cl-+H2O
.同温同压下,将 a L M气体和b L N气体通入水中,若所得溶液的pH=7,则a>
>
b(填“>”或“<”或“=”).