网址:http://m.1010jiajiao.com/timu_id_179304[举报]
一、
题号
1
2
3
4
5
答案
A
D
C
B
C
二、
题号
6
7
8
9
10
11
12
13
14
15
16
17
答案
D
D
C
C
D
B
D
B
B
D
C
D
三、
题号
18
19
20
21
22
答案
C
AD
AC
C
BD
四、(本题共24分)
23、(每空1分,共8分)
(1)N , S
⑵ SiO2,SiO2是原子晶体,而CO2是分子晶体; H2O,水分子间作用力大于H2S分子间作用力; (3) Na2O2 (或FeS2;Na2SX等等,填写任意一个正确的即可);
(4) 
 24、(本题共8分)
24、(本题共8分)
(1) (方程式 1分,配平 1分,电子转移方向与数目 2分)
(2) SnCl2 , 3×6.02×1023 (每空1分,共2分) (3)1:1 (2分)
25、(本题共8分)
(1)放热 (1分)  (2)① 0.0175mol/L•min (1分) ②平衡(1分)
(2)① 0.0175mol/L•min (1分) ②平衡(1分)
③ 是 ,等于 ,
(每空1分,共3分) ④ a、b (2分)
五、(本题共24分)
26、(本题共12分)
(1)吸收空气中的CO2, 偏高 (每空1分,共2分)
(2)装置C反应前后质量 (1分)
(3),(5×c×v×10-3×84 )/ m1 (2分)
(4)NaHCO3(其他合理答案也可)(1分)(5)b (1分) (6)蒸发 (1分)
(7)烧杯、酒精灯 (每空1分,共2分) (8)偏高 (2分)
27、(本题共12分)
(1) 把装置中的空气赶走,防止NO被氧化为NO2 ,干燥反应中生成的气体 (每空1分,共2分) (2) 无色气体变为红棕色 ,热 (每空1分,共2分)
(3) 打开K1、K2持续通入一段时间的N2和O2 (2分)
(4)① 0.5 ②C中烧瓶在实验前后增加的质量 (每空2分,共4分)
(5)在A中加入过量含Cl-溶液,过滤后,将沉淀洗涤、干燥,最后称取沉淀的质量(2分)
(其他合理答案也可)
六、(本题共20分)
 28、(本题共8分)
28、(本题共8分)
(1)(各1分,共2分)
(2)(各1分,共2分)消去反应 酯化反应(或取代反应)
(3)(各2分,共4分)


29.(本题共12分)
(1)羟基 羧基
(各1分,共2分) (2分)
(2分)
 (2)HOCH2―CH2OH+O2
OHC―CHO+2H20 (2分) (3)B E (2分)
(2)HOCH2―CH2OH+O2
OHC―CHO+2H20 (2分) (3)B E (2分)
(4)(各2分,共4分) 
 (其他合理答案也可)
(其他合理答案也可)
七、(本题共16分)
30、(本题共6分)
(1)x=1 (2分)
(2)14.4 (2分)
(3)6 (2分)
31、(每空2分,共10分)
(1).2.8×105 ;18
(2).86.96%
(3). ;138
;138
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。
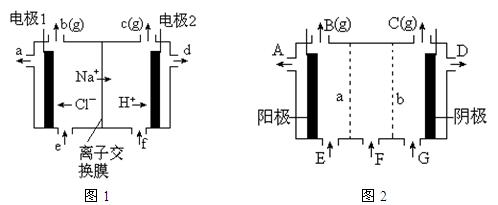
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO![]() 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO![]() ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
查看习题详情和答案>>图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO![]() 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO![]() ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
查看习题详情和答案>>
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。

⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
查看习题详情和答案>>
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO
 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。