摘要:20.(1)N CO2 (2)3S23P4 .H―O―O―H . 极性键.非极性键(3)原子.2:3 (4) (NH4)2CO3
网址:http://m.1010jiajiao.com/timu_id_175990[举报]
化合物C2H4、CH3CHO、CH3CH2COOH、C6H12O6完全燃烧时生成CO2和H2O的物质的量之比为1∶1,符合该条件的有机物的通式可用__________表示。现有一些只含两个碳原子的烃的衍生物,完全燃烧后只生成CO2和H2O,且CO2和H2O的物质的量之比符合如下比值,请在横线上写出有机物的结构简式:?
(1)n(CO2)∶n(H2O)=2∶3的有__________、__________、__________(三种)。
(2)n(CO2)∶n(H2O)=1∶1且能发生酯化反应,但不能与Na2CO3溶液反应的有__________(一种)。
查看习题详情和答案>>
写出符合下列条件的二碳烃的衍生物的结构简式,这些有机物完全燃烧时的产物只有CO2和H2O,CO2和H2O的分子数比符合如下比值:
(1)n(CO2)∶n(H2O)=2∶1的有________、________、________。
(2)n(CO2)∶n(H2O)=1∶1的有________、________、________、________。
(3)n(CO2)∶n(H2O)=2∶3的有________、________、________。
查看习题详情和答案>>
氮元素及其化合物在国防科学技术生产中有重要应用.
(1)写出实验室制NH3的化学反应方程式 .
(2)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式 .
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
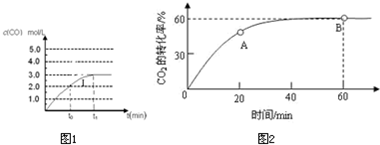
(4)在容积为2L容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),已知c(CO)与反应时间t变化曲线Ⅰ,若在t0时刻将容器的体积扩大至4L,请在图1中绘出c(CO)与反应时间t变化曲线Ⅱ.
(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为 .
(6)合成尿素,当氨碳比
=4,CO2的转化率随时间的变化关系如图2所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率为v正(CO2)(填“>”、“<”或“=”).
②NH3的平衡转化率为 .
查看习题详情和答案>>
(1)写出实验室制NH3的化学反应方程式
(2)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有

(4)在容积为2L容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),已知c(CO)与反应时间t变化曲线Ⅰ,若在t0时刻将容器的体积扩大至4L,请在图1中绘出c(CO)与反应时间t变化曲线Ⅱ.
(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为
(6)合成尿素,当氨碳比
| n(NH3) | n(CO2) |
①A点的逆反应速率v逆(CO2)
②NH3的平衡转化率为
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
(1)N的电极反应式为
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K=
 ,
,
②条件相同时,反应I与反应II相比,转化程度更大的是
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:温度升高,K值
查看习题详情和答案>>

(1)N的电极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
1.12
1.12
L(标准状况下).(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
4.6
4.6
g.(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
| ||
反应II:2CO2(g)+4H2(g)
| ||
①写出反应I的平衡常数表达式K=


②条件相同时,反应I与反应II相比,转化程度更大的是
反应II
反应II
.③在一定压强下,测得反应I的实验数据如下表:
温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”或“不变”),提高氢碳比.n(H2)/n(CO2),对生成乙醇有利
有利
(填“不利”或“有利”). (2013?深圳一模)CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
(2013?深圳一模)CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
研究温度对该化学平衡的影响
研究温度对该化学平衡的影响
.(2)180℃时,反应到40min,体系
是
是
(填“是”或“否”)达到平衡状态,理由是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态
温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态
;CH4的平衡转化率为70%
70%
.(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图象中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注.
(5)根据已知求算:△H2=
-1160KJ/mol
-1160KJ/mol
.CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g);△H1=-574kJ?mol-1
CH4(g)+4NO(g?2N2(g)+CO2(g)+2H2O(g);△H2.