摘要:⑵2NaCl+3H2SO4+MnO2 2NaHSO4+MnSO4+2H2O+Cl2↑Cl2+2NaOH=NaCl+NaClO+H2O
网址:http://m.1010jiajiao.com/timu_id_17557[举报]
图中A~I分别表示化学反应中的一种常见物质,工业上常用电解A的饱和溶液的方法制取B.其中E、F、J在通常情况下是气体单质,E为有色气体,J是空气中含量最多的气体,X是一种常见的金属单质.部分产物和反应条件略去.
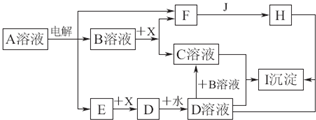
填写下列空白:
(1)写出电解A溶液的化学方程式:
(2)若将a mol D全部转化为C,则B的物质的量的取值范围为
(3)写出下列反应的离子方程式:
H+D→I:
B+X→C+F:
E与B溶液的反应:
查看习题详情和答案>>

填写下列空白:
(1)写出电解A溶液的化学方程式:
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
,电解过程中,向两极溶液中滴加酚酞试液,有一极溶液颜色变红,则该极为
| ||
阴
阴
(填“正”、“负”、“阴”或“阳”)极,该极的电极反应为2H++2e-═H2↑
2H++2e-═H2↑
.(2)若将a mol D全部转化为C,则B的物质的量的取值范围为
n(NaOH)≥4amol
n(NaOH)≥4amol
.(3)写出下列反应的离子方程式:
H+D→I:
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+
;B+X→C+F:
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
;E与B溶液的反应:
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
. A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.(1)C元素在周期表中的位置
第三周期、第 VIIA族
第三周期、第 VIIA族
.(2)A元素与水反应的离子方程式是
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式
Cl2+Na2S=2NaCl+S↓
Cl2+Na2S=2NaCl+S↓
.(4)BD2和C2均具有漂白性,二者的漂白原理
不同
不同
.(填“相同”或“不同”)(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:3H2+N2
 2NH3△H=-92.4kJ?mol-1
2NH3△H=-92.4kJ?mol-1①当合成氨反应达到平衡后,改变某一外界条件 (不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1时引起平衡移动的条件可能是
加压
加压
,其中表示平衡混合物中NH3的含量最高的一段时间是t2-t3
t2-t3
.②温度为T℃时,将2a molH2和a molN2放入0.5L 密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为
| 4 |
| a2 |
| 4 |
| a2 |
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
(1)C元素在周期表中的位置
(2)A元素与水反应的离子方程式是
(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式
(4)BD2和C2均具有漂白性,二者的漂白原理
(5)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2=BO2(g);△H=-296.8kj?mol-1
2BD2(s)+O2(g) 2BO3(g);△H=-196.6kJ?mol-1
2BO3(g);△H=-196.6kJ?mol-1
则1mol BO3(g)若完全分解成B(s),反应过程中的热效应为
(6)氢氧燃料电池能量转化率高,具有广阔的发展前景.如图(1)所示,电池中正极的电极反应式为
(7)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NGH3(g);△H=-92.4kJ/mol
2NGH3(g);△H=-92.4kJ/mol

①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图(2)所示.图中t1时引起平衡移动的条件可能是
②温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为
.
查看习题详情和答案>>
(1)C元素在周期表中的位置
第三周期,第VIIA族
第三周期,第VIIA族
.(2)A元素与水反应的离子方程式是
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式
Cl2+Na2S=2NaCl+S↓
Cl2+Na2S=2NaCl+S↓
.(4)BD2和C2均具有漂白性,二者的漂白原理
不同
不同
.(填“相同”或“不同”)(5)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2=BO2(g);△H=-296.8kj?mol-1
2BD2(s)+O2(g)
 2BO3(g);△H=-196.6kJ?mol-1
2BO3(g);△H=-196.6kJ?mol-1则1mol BO3(g)若完全分解成B(s),反应过程中的热效应为
△H=+395.1kJ/mol
△H=+395.1kJ/mol
.(6)氢氧燃料电池能量转化率高,具有广阔的发展前景.如图(1)所示,电池中正极的电极反应式为
O2+2H20+4e-=4OH-
O2+2H20+4e-=4OH-
.(7)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)
 2NGH3(g);△H=-92.4kJ/mol
2NGH3(g);△H=-92.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图(2)所示.图中t1时引起平衡移动的条件可能是
加压
加压
.其中表示平衡混合物中NH3的含量最高的一段时间是t2-t3
t2-t3
.②温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为
| 4 |
| a2 |
| 4 |
| a2 |
写出下列反应的化学方程式
(1)工业合成氨
(2)氯碱工业主反应
(3)氯化铝与氨水反应(离子方程式)
(4)铝与氢氧化钠溶液反应
(5)铜与稀硝酸反应(离子方程式)
(6)二氧化硫使溴水褪色
(7)工业制漂白粉
查看习题详情和答案>>
(1)工业合成氨
N2+3H2
=2NH3,
| ||
| 高温高压 |
N2+3H2
=2NH3,
;
| ||
| 高温高压 |
(2)氯碱工业主反应
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
;
| ||
(3)氯化铝与氨水反应(离子方程式)
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;(4)铝与氢氧化钠溶液反应
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
;(5)铜与稀硝酸反应(离子方程式)
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
;(6)二氧化硫使溴水褪色
SO2+Br2+2H2O=H2SO4+2HBr
SO2+Br2+2H2O=H2SO4+2HBr
;(7)工业制漂白粉
2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
.下表是元素周期表的一部分.
(1)表中所列元素中,最稳定的气态氢化物的化学式
(2)某元素原子的核外M层电子数是元素②最外层电子数的1/2,则该元素的元素符号是
 .
.
(3)某元素是组成蛋白质的重要成分,蛋白质又是生命的存在形式,因此此元素被称为“生命元素”,此元素的名称为
 ,用化学方程式表示其单质的一种重要的工业用途:
,用化学方程式表示其单质的一种重要的工业用途:
(4)④与⑥形成原子个数之比为1:1的化合物的电子式为
 ,用电子式表示⑤和⑩形成化合物的过程
,用电子式表示⑤和⑩形成化合物的过程

(5)写出下列化学方程式
⑤的单质通入⑥和⑨形成化合物的水溶液中
⑨的单质通入⑥和(11)形成化合物的水溶液中
查看习题详情和答案>>
| 族 周期 |
II A | IV A | VII A | ||||
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| ⑥ | ⑦ | ⑧ | ⑨ | ||||
| ⑩ | (11) | ||||||
HF
HF
,原子半径最小的元素的元素符号是H
H
.(2)某元素原子的核外M层电子数是元素②最外层电子数的1/2,则该元素的元素符号是
Mg
Mg
,其元素原子结构示意图为

(3)某元素是组成蛋白质的重要成分,蛋白质又是生命的存在形式,因此此元素被称为“生命元素”,此元素的名称为
氮
氮
,其单质的电子式为

N2+3H2
2NH3
| 高温高压 |
| 催化剂 |
N2+3H2
2NH3
.| 高温高压 |
| 催化剂 |
(4)④与⑥形成原子个数之比为1:1的化合物的电子式为




(5)写出下列化学方程式
⑤的单质通入⑥和⑨形成化合物的水溶液中
2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2
⑨的单质通入⑥和(11)形成化合物的水溶液中
Cl2+2NaBr=2NaCl+Br2
Cl2+2NaBr=2NaCl+Br2
.