网址:http://m.1010jiajiao.com/timu_id_17460[举报]
 (I)滴定分析法是化学分析法中的重要分析方法之一.
(I)滴定分析法是化学分析法中的重要分析方法之一.(一)用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
A.实验步骤:
(1)用酸式滴定管量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为
(4)滴定.当
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
B.实验记录
| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
(二)用双指示剂法测定纯碱的含量
如图的滴定曲线表示:用0.1000mol/L HCl滴定 20.00ml 0.1000mol/L Na2CO3

①A处选用
②当滴定至混合液pH接近4时,为了防止终点出现过早,减少实验误差,应剧烈摇动溶液或加热一会溶液,冷却后再继续滴定,这样做的理由是:
(II)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧物质是否也可以作H2O2溶液分解的催化剂?探究过程如下.
(1)[猜想]:Al2O3能作过氧化氢分解的催化剂.
(2)[实验验证]:
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少) ? ? |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 Al2O3能加快H2O2溶液的分解速率 |
(4)[讨论与反思]:有的同学认为只有上述两个实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用.还应补充实验来验证:
(5)另外化学兴趣小组为比较Fe3+和Cu2+对H2O2分解的催化效果,该组同学设计了如图所示的实验.可通过观察反应产生气泡快慢或反应完成的先后或试管壁的冷热程度定性比较得出结论.有同学提出将CuSO4改为CuCl2更为合理,其理由是

(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为: ;
预期现象是:
①溶液的颜色由 色变为 色,
②其中加入 mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 | A(KMnO4溶液浓度/mol·L-1) | B(草酸溶液浓度/mol·L-1) | C(硫酸溶液浓度/mol·L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
| | A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | ||||||
| 浓度/mol·L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
(2)由表2可知,三因素中, 的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而 的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为 mol·L-1、草酸浓度为 mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
| c(H2SO4)/mol·L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为 mol·L-1和 mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
(1)雷雨天后,一同学取一杯外观浑浊的河水,他在水中加了几颗明矾晶体,搅拌后不一会儿,就变澄清透明,杯底有沉淀物。沉淀物的主要成分是___________,加明矾晶体搅拌后变澄清透明的原因是_________________________________。
(2)某同学家附近有一口老井,井中之水冬天温热、夏天冰凉,清澈无比。他从井中取了一杯清澈的井水到实验室里,加了几滴明矾溶液。结果观察到白色浑浊、少量无色气泡产生等现象。推测这口老井水为什么会有“冬温夏凉”的现象?清澈的井水中加明矾为什么会产生沉淀和气泡?
(3)假期时某同学到一农村的亲戚家去度假,由于那里还没装自来水,日常用水都是从村边的一口井里取来的。有一次他偶然发现,头一天取回的清澈井水表面产生了一层暗红色的“锈皮”,水桶底下还沉积有少量泥沙似的杂质。此后,他天天观察,原来这个现象天天都存在。经过分析他提出了一个假设, 并取样回到学校实验室里进行了验证,证实了自己的假设。请你推测井水中可能含有较多的金属离子是___________,你认为该同学可以用什么方案验证所提出的假设______________________。
查看习题详情和答案>>没有水就没有生命,自然界中的水丰富多样。下面是某中学一研究小组在研究水时所记录的实验现象,请根据已学知识解释。
(1)雷雨天后,一同学取一杯外观浑浊的河水,他在水中加了几颗明矾晶体,搅拌后不一会儿,就变澄清透明,杯底有沉淀物。沉淀物的主要成分是___________,加明矾晶体搅拌后变澄清透明的原因是_________________________________。
(2)某同学家附近有一口老井,井中之水冬天温热、夏天冰凉,清澈无比。他从井中取了一杯清澈的井水到实验室里,加了几滴明矾溶液。结果观察到白色浑浊、少量无色气泡产生等现象。推测这口老井水为什么会有“冬温夏凉”的现象?清澈的井水中加明矾为什么会产生沉淀和气泡?
(3)假期时某同学到一农村的亲戚家去度假,由于那里还没装自来水,日常用水都是从村边的一口井里取来的。有一次他偶然发现,头一天取回的清澈井水表面产生了一层暗红色的“锈皮”,水桶底下还沉积有少量泥沙似的杂质。此后,他天天观察,原来这个现象天天都存在。经过分析他提出了一个假设, 并取样回到学校实验室里进行了验证,证实了自己的假设。请你推测井水中可能含有较多的金属离子是___________,你认为该同学可以用什么方案验证所提出的假设______________________。
查看习题详情和答案>>2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mL CCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
已知:v(正)=k?cm(I-)?cn(Fe3+)(k为常数)
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
(3)该反应的平衡常数表达式为
(4)已知改变I-、Fe3+的浓度,正反应速率对应数值如下表所示:
| c(I-)/mol?L-1 | c(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
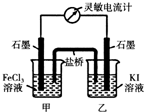
(5)现将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池
①能说明反应达到平衡的标志是
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时