摘要:(1)NaCl.NaClNaBr.NaClNaBrNaI (2) 30%
网址:http://m.1010jiajiao.com/timu_id_174265[举报]
与100mL 0.1mol?L-1 Na2SO4溶液中含有的Na+数目相同的是( )
| A、0.1mol?L-1 NaNO3溶液50mL | B、0.2mol?L-1 NaOH溶液100mL | C、0.2mol?L-1 NaCl溶液50mL | D、0.1mol?L-1 NaHCO3溶液100mL |
(1)氯酸钾熔化,粒子间克服了
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称: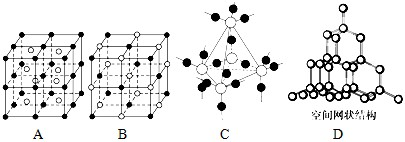
A.
查看习题详情和答案>>
离子键
离子键
的作用力;二氧化硅熔化,粒子间克服了共价键
共价键
的作用力;碘的升华,粒子间克服了分子间
分子间
的作用力.三种晶体的熔点由高到低的顺序是SiO2>KClO3>I2
SiO2>KClO3>I2
.(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为
①⑤③②④⑥
①⑤③②④⑥
(填序号).(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有
CO2
CO2
,由非极性键形成的非极性分子有H2
H2
,能形成分子晶体的物质是H2、CO2、HF
H2、CO2、HF
,含有氢键的晶体的化学式是HF
HF
,属于离子晶体的是(NH4)2SO4
(NH4)2SO4
,属于原子晶体的是SiC
SiC
,五种物质的熔点由高到低的顺序是SiC>(NH4)2SO4>HF>CO2>H2
SiC>(NH4)2SO4>HF>CO2>H2
.(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.
金属晶体
金属晶体
;B.分子晶体
分子晶体
;C.离子晶体
离子晶体
;D.原子晶体
原子晶体
.(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:

A.
CsCl
CsCl
;B.NaCl
NaCl
;C.SiO2
SiO2
;D.金刚石
金刚石
.