网址:http://m.1010jiajiao.com/timu_id_173102[举报]

(1)实验时,B中发生反应的化学方程式为
| ||
| ||
(2)装置C、D中盛放的试剂分别为:C
(3)E装置中的仪器名称是
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是
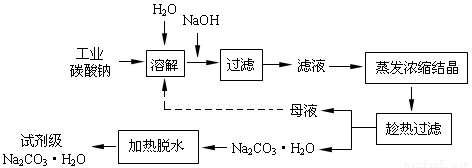
(14分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: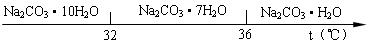
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(1)加入NaOH溶液时发生的离子方程式为:
▲ 。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c(
 M
M g2+):c(Fe3+)= ▲ 。
g2+):c(Fe3+)= ▲ 。(2
 )“趁热过滤”时的温度应控制在
)“趁热过滤”时的温度应控制在  ▲ 。
▲ 。(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请你分析实际工业生产中是否可行 ▲ ,并说明理由:
▲ 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 53
 2.36kJ·mol-1
2.36kJ·mol-1Na2CO3·10 H2O
 (s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1写出Na2CO3·H2O脱水反应的热化学方程式 ▲ 。 查看习题详情和答案>>
(14分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:

Ⅱ、25℃时有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为:
▲ 。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c(Mg2+):c(Fe3+)= ▲ 。
(2)“趁热过滤”时的温度应控制在 ▲ 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请你分析实际工业生产中是否可行 ▲ ,并说明理由:
▲ 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 532.36kJ·mol-1
Na2CO3·10 H2O (s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 ▲ 。
查看习题详情和答案>>
(10分)工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下: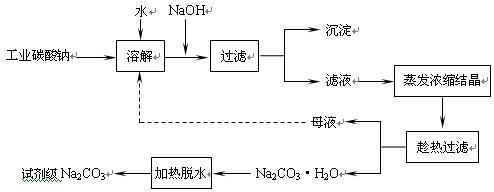
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
 (1)加入NaOH溶液时发生的离子反应方程式为 ▲ 、 ▲ 。
(1)加入NaOH溶液时发生的离子反应方程式为 ▲ 、 ▲ 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) ▲ 。
(3)“趁热过滤”时的温度应控制在 ▲ 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式 ▲ 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行 ▲ ,其理由是 ▲ 。