网址:http://m.1010jiajiao.com/timu_id_172716[举报]
一、选择题(每小题只有一个正确答案,本题共54分)
1
2
3
4
5
6
7
8
9
C
B
B
A
D
D
B
B
C
10
11
12
13
14
15
16
17
18
C
A
B
B
A
C
C
C
A
(注:下列分值除注明的方程式3分之外,其他方程式每个2分,每空1分。)
二、填空题(26分)
19.(1)7;K2O、K2O2(KO2也可以)。
(2) (3)S2->Cl->Mg2+>Al3+
(3)S2->Cl->Mg2+>Al3+
(4)Na (5)H2O ;SiH4
(6)HS- +H3O+ = H2S +H2O HS-+OH- = S2-+H2O
20.(1)5
K
(2)C CO2
(3)5
21.(1)PCl3
(2) P(s)+Cl2(g)=== PCl3(g);△H=-306kJ?mol-1 (3分)
(3) PCl5(g)===PCl3(g)+Cl2(g);△H=+93kJ?mol-1 (3分)
(4)PCl5+4H2O===H3PO4+5HCl。
三、推断题(15分)
22.(1)(1)甲: Al2(SO4)3 ,乙:K2CO3 ,丙:AgNO3 ,丁:BaCl2,戊:NH4Br
(2)2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑
23.CaCl2 电子式:略; HClO4 HF
(2)SiO2 + 4HF = SiF4 + 2H2O
四、实验题(9分)
 (1)4H++2Cl─+MnO2 Mn2++Cl2↑+2H2O
(1)4H++2Cl─+MnO2 Mn2++Cl2↑+2H2O
(2)干燥管;除去氯气中的氯化氢
(3)使密度较大的氯气与密度较小的氨气能较快地均匀混合
(4)3Cl2+8NH3 ==N2+6NH4Cl b/2 amol-1
(5)在G连接导管,直接把尾气通入盛有烧碱溶液的烧杯中。
五、计算题(6分)
(1)2片小苏打所含NaHCO3的质量为
其物质的量为
由HCO3-+H+=== CO2↑+H2O,可知n(H+)=0.012mol。
(2)6片小苏打的物质的量为:0.036mol,即中和的H+为0.036mol,而每片的Al(OH)3
的物质的量为
中和的H+为0.009mol,所以Al(OH)3的片数为:0.036÷0.009 = 4片。
往含0.2 mol NaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当气体为6.72 L(标态)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)

查看习题详情和答案>>
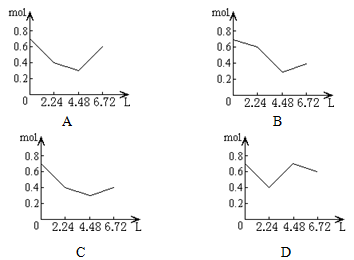
往含0.2 mol NaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当气体为6.72 L(标态)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)
|
往含 0.2 mol NaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72 L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计) | |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
(1)NA为阿伏加德罗常数。25℃时,1g水中含H+离子个数约为__________NA。
(2)通过氨的催化氧化法制取硝酸,在此全过程中,理论上氨与所耗氧气的物质的量比为__________,这样所得硝酸的质量分数为_____________。
(3)往含0.2 mol NaOH和0.1 mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5 mol。请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图。(不计弱电解质的电离和盐的水解)

(4)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为0.4, 480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)
查看习题详情和答案>>



